Induktiver Effekt
Der Induktive Effekt oder I-Effekt ist in der organischen Chemie ein ladungsverändernder Effekt, der sowohl als +I-Effekt („elektronenschiebend“) als auch als −I-Effekt („elektronenziehend“) auftritt. Er wird durch elektrostatische Induktion durch funktionelle Gruppen entlang einer oder mehrerer chemischer Bindungen ausgelöst. Das Konzept wurde von den Chemikern Gilbert Newton Lewis und Christopher Kelk Ingold entwickelt.
Grundlage
Die Ursache dieser Effekte ist eine Asymmetrie in der Verteilung der Elektronen in einer Elektronenpaarbindung zwischen zwei gleichen, aber unterschiedlich substituierten Atomen oder zwischen zwei unterschiedlichen Atomen. Zwei Atome, die durch eine Elektronenpaarbindung gebunden sind, teilen sich zwei Elektronen. Diesen Elektronen ist kein fester Platz zugewiesen, sondern sie sind innerhalb dieser Bindung frei beweglich. Die Elektronen werden im Fall einer Asymmetrie der Elektronenverteilung zu dem Atom hingezogen, dessen Elektronegativität größer ist.
Man unterscheidet zwei Arten von I-Effekten: den +I-Effekt (sprich: positiver induktiver Effekt) und den −I-Effekt (sprich: negativer induktiver Effekt). Ein elektronegativeres Atom übt einen −I-Effekt aus, sodass sich die Elektronendichte bei dem anderen Atom verringert. Bei einem +I-Effekt werden die Elektronen von dem einen Atom weggeschoben und somit die Elektronendichte an dem anderen Atom erhöht. Die Bindung weist nun einen Dipolcharakter auf, der durch δ+ am Atom mit der geringeren Ladungsdichte und δ− am Atom mit der hohen Ladungsdichte gekennzeichnet wird. Um die Stärke des induktiven Effektes von Atomen oder Atomgruppen zu vergleichen, wird die Elektronegativität des Substituenten mit der Elektronegativität des Wasserstoffs verglichen. Je größer die Differenz der Elektronegativitäten, desto stärker ist der induktive Effekt.
Allgemeines
Kovalente Bindungen können, je nach Elektronegativität der Bindungspartner, polarisiert sein, also als polare Atombindungen vorliegen. Ist eines der Elemente elektronegativer als sein Bindungspartner, so halten sich die Elektronen häufiger in seiner Nähe auf. Dadurch verschiebt sich die Ladungsverteilung, sodass das elektronegativere Element mehr oder weniger stark negativ polarisiert ist. Entlang der Bindung liegt ein Bindungsdipolmoment vor.
Als Beispiel ist hier Wasser (H2O) anzuführen. Durch die höhere Elektronegativität halten sich die Elektronen häufiger beim Sauerstoff-Atom auf. Im Wassermolekül wird dies durch δ− in der Nähe des O-Atoms, sowie durch jeweils ein δ+ neben jedem der beiden H-Atome ausgedrückt. Oft wird das δ− beim Sauerstoff etwas größer geschrieben. Dies ist üblich, da die δ−-Ladung des Sauerstoff-Atoms doppelt so hoch ist wie die jedes einzelnen Wasserstoff-Atoms. Durch Vektoraddition der einzelnen Bindungsdipolmomente ergibt sich das elektrische Dipolmoment des Moleküls. Bindungsdipolmomente und elektrisches Dipolmoment sollten nicht miteinander verwechselt werden: So haben symmetrisch gebaute Moleküle wie z. B. Kohlenstoffdioxid (O=C=O) polare Bindungen, aber kein elektrisches Dipolmoment.
-
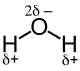
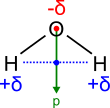
Bindungsdipolmomente des Wassermoleküls Bindungsdipolmomente und elektrisches Dipolmoment eines H2O-Moleküls. In grün: elektrisches Dipolmoment .
Der induktive Effekt kann sich über mehrere Bindungen hinweg auf andere Atome oder Atomgruppen auswirken. Die Stärke nimmt jedoch mit dem Quadrat der Entfernung ab. Man geht davon aus, dass sich induktive Effekte nicht weiter als drei benachbarte Bindungen auswirken. Tritt ein induktiver Effekt in einem Molekül wie beispielsweise 1-Fluorpropan auf, so wirkt die induktive Kraft auch auf die in einer Kette folgenden Atome:
Das Fluor-Atom löst einen Induktionseffekt aus, der sich auf die drei folgenden Kohlenstoffatome auswirkt. Am stärksten ist der Induktionseffekt auf das erste Kohlenstoffatom, das direkt an das Fluoratom gebunden ist, dies wird durch das Symbol δ+ indiziert. Die Stärke nimmt allerdings ab, je weiter das betroffene Kohlenstoffatom vom Fluoratom entfernt ist. Auf das zweite Kohlenstoffatom in der Alkyl-Kette ist der Induktionseffekt geringer, was durch die Markierung δδ+ ausgedrückt wird. Wiederum sehr viel geringer wirkt sich der induktive Effekt des Fluoratoms auf das noch weiter vom Fluoratom entfernte dritte Kohlenstoffatom aus, was durch die Markierung δδδ+ ausgedrückt wird.
In der Regel betrachtet man I-Effekte bei komplexeren Verbindungen. Dadurch ist es möglich, das Verhalten der Verbindungen zu analysieren. Beispielsweise hat der −I-Effekt bei Trichloressigsäure weitergehende Auswirkungen. In dieser Verbindung üben drei Cl-Atome am C-Atom einen −I-Effekt aus. Dadurch zieht das C-Atom die Elektronen des ihm benachbarten C-Atoms zu sich, wodurch dieses C-Atom Elektronen vom benachbarten und einfach gebundenen Sauerstoff zu sich zieht. Die Bindung zwischen dem O-Atom und dem mit ihm verbundenen H-Atom ist dadurch geschwächt und das H+-Ion (Proton) sehr leicht abspaltbar.
+I-Effekt
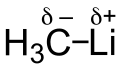
Einen +I-Effekt haben Teilchen, die elektronenschiebend wirken. Dies geschieht z.B., wenn das Teilchen negativ geladen ist oder eine niedrige Elektronegativität besitzt. Ebenso ist der +I-Effekt bei der Ausbildung von Hybridorbitalen zu beobachten, so wirkt z.B. die Methylgruppe CH3 elektronenschiebend, auch wenn das aufgrund der C–C-Einfachbindung nicht einzusehen ist.
−I-Effekt
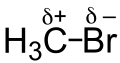
Den −I-Effekt haben Atome, die elektronenziehend wirken. Dies kommt in der Regel durch hohe Elektronegativität oder eine positive Ladung zustande. Stark elektronegative Teilchen ziehen besonders stark Elektronen an.
Auswirkungen des Induktionseffektes
Die Auswirkungen des Induktionseffektes sind, dass andere polare Moleküle sich nun am besagten Molekül ausrichten und es angreifen können. Zudem hat der Induktionseffekt Einfluss auf die Lage der Zweit-Substituenten an aromatischen Systemen. Radikale oder Carbeniumionen (Carbokationen), also Teilchen mit Elektronenmangel, werden durch Substituenten mit +I-Effekt stabilisiert und durch solche mit -I-Effekt destabilisiert. Abgesehen davon hat der induktive Effekt entscheidenden Einfluss auf die Säurestärke eines Moleküls. Verfügt ein Molekül beispielsweise über einen stark elektronegativen (elektronenanziehenden) Substituenten, wird die Abspaltung eines Protons erleichtert (−I-Effekt), die Säurestärke ist entsprechend groß. Umgekehrt führt ein elektronenschiebender Substituent zu einer geringen Säurestärke (+I-Effekt).
Der +I-Effekt hat auch Einfluss auf die Stellung des Zweitsubstituenten bei der elektrophilen aromatischen Substitution. Ein Erstsubstituent mit +I-Effekt schiebt Elektronen in das System hinein. Der induktive Effekt nimmt jedoch in der Entfernung schnell ab. Wenn Substituenten in ortho- oder para-Stellung gebunden werden, dann entsteht als Übergangszustand ein Kation, das in mehreren Resonanzformeln dargestellt werden kann. Dabei gibt es immer eine Resonanzformel, bei der sich die positive Ladung des Kations bei dem C-Atom befindet, das den Erstsubstituenten gebunden hat. Dadurch, dass sich bei dieser Resonanzformel die hineingeschobenen Elektronen direkt neben der positiven Ladung befinden, wird das Kation stabilisiert. Die stabileren Übergangszustände bei der ortho- oder para-Stellung haben eine relativ geringe Energie und sind deshalb auch relativ schnell erreicht (siehe Hammond-Postulat). Man sagt auch, dass Erstsubstituenten mit +I-Effekt in ortho- oder para-Stellung dirigieren. Die para-Stellung wird aufgrund geringerer sterischer Hinderung vor der ortho-Stellung bevorzugt.
Induktiv wirkende Gruppen
Hier sind einige induktiv wirkende Gruppen gelistet:
+I (positiver induktiver Effekt)
- t-Butylgruppe –C(CH3)3
- i-Propylgruppe –CH(CH3)2
- Alkylrest –R
I=0 (kein induktiver Effekt)
−I (negativer induktiver Effekt)
- Sauerstoff in der Carbonylgruppe –C=O
- Hydroxygruppe –OH
- Iodatom –I
- Bromatom –Br
- Chloratom –Cl
- Nitrogruppe –NO2
- Aminogruppe –NH2
- Carboxygruppe –COOH
- Fluoratom –F
- Cyanogruppe –CN


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 16.04. 2025