
Tyrosin
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Toxikologische Daten | 5110 mg/kg (LD50, Maus, oral) | ||||||
Tyrosin (abgekürzt Tyr oder Y) ist in seiner natürlichen L-Form eine nichtessentielle proteinogene α-Aminosäure, die in den meisten Proteinen vorkommt. Tyrosin ist Ausgangssubstanz für die Biosynthese von DOPA, Katecholaminen (z.B. Dopamin), Melanin, Thyroxin und Tyramin. Die Biosynthese erfolgt in vielen Tieren aus der essentiellen Aminosäure Phenylalanin, eine Beeinträchtigung dieses Weges kann vielfältige Defekte auslösen.
| Strukturformel | |
|---|---|
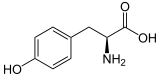
| |
| Struktur von L-Tyrosin, dem natürlich vorkommenden Isomer | |
| Allgemeines | |
| Name | Tyrosin |
| Andere Namen |
|
| Summenformel | C9H11NO3 |
| Kurzbeschreibung | farblose, seidig glänzende Nadeln |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| EG-Nummer | 200-460-4 |
| ECHA-InfoCard | 100.000.419 |
| PubChem | 6057 |
| ChemSpider | 5833 |
| DrugBank | DB00135 |
| Eigenschaften | |
| Molare Masse | 181,19 g/mol |
| Aggregatzustand | fest |
| Dichte | 1,46 g/cm3 (25 °C) |
| Schmelzpunkt | 342–344 °C (Zersetzung) |
| pKS-Wert |
|
| Löslichkeit |
|
Isomere
Tyrosin besitzt ein Stereozentrum, somit existieren zwei Enantiomere. Wenn in diesem Text oder in der wissenschaftlichen Literatur „Tyrosin“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist das natürlich vorkommende L-Tyrosin gemeint.
| Enantiomere von Tyrosin | ||
| Name | L-Tyrosin | D-Tyrosin |
| Andere Namen | (S)-(−)-Tyrosin | (R)-(+)-Tyrosin |
| Strukturformel |  |
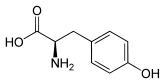
|
| CAS-Nummer | 60-18-4 | 556-02-5 |
| 556-03-6 (unspez.) | ||
| EG-Nummer | 200-460-4 | 209-112-6 |
| 209-113-1 (unspez.) | ||
| ECHA-Infocard | 100.000.419 | 100.008.285 |
| 100.008.286 (unspez.) | ||
| PubChem | 6057 | 71098 |
| 1153 (unspez.) | ||
| DrugBank | DB00135 | − |
| − (unspez.) | ||
Vorkommen

L-Tyrosin wurde von Justus von Liebig 1846 erstmals als Proteinbestandteil von Käse (altgriechisch τύρος týros ‚Käse‘) charakterisiert, daher leitet sich auch der Name ab. Es kommt in großen Mengen im Casein vor.
Die folgenden Beispiele geben einen Überblick über Tyrosingehalte und beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Tyrosin am Gesamtprotein angegeben:
| Lebensmittel je 100 g | Protein | Tyrosin | Anteil |
|---|---|---|---|
| Schweinefleisch, roh | 20,95 g | 797 mg | 3,8 % |
| Hähnchenbrustfilet, roh | 21,23 g | 765 mg | 3,6 % |
| Lachs, roh | 20,42 g | 759 mg | 3,7 % |
| Hühnerei | 12,56 g | 499 mg | 4,0 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 158 mg | 4,8 % |
| Kürbiskerne | 30,23 g | 1093 mg | 3,6 % |
| Walnüsse | 15,23 g | 406 mg | 2,7 % |
| Weizenmehl | 10,33 g | 312 mg | 3,0 % |
| Mais-Vollkornmehl | 6,93 g | 282 mg | 4,1 % |
| Reis, ungeschält | 7,94 g | 298 mg | 3,8 % |
| Sojabohnen, getrocknet | 36,49 g | 1539 mg | 4,2 % |
| Erbsen, getrocknet | 24,55 g | 711 mg | 2,9 % |
Alle diese Nahrungsmittel enthalten praktisch ausschließlich chemisch gebundenes L-Tyrosin als Proteinbestandteil, jedoch kein freies L-Tyrosin.
Eigenschaften
Als Monomer
Abhängig vom pH-Wert kann Tyrosin als „inneres Salz“ bzw. Zwitterion vorliegen. Das Proton der Carboxygruppe lagert sich hierbei an das freie Elektronenpaar des Stickstoffatoms der Aminogruppe an:
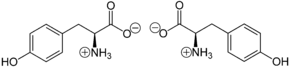
Die Zwitterionen wandern nicht im elektrischen Feld, da sie nach außen hin ungeladen sind. Der isoelektrische Punkt liegt bei pH = 5,66 für Tyrosin; es hat bei diesem pH-Wert seine geringste Löslichkeit in Wasser.
Isoliertes L-Tyrosin fluoresziert – wie viele andere aromatische Verbindungen – bei Anregung mit UV-Licht.
- Van-der-Waals-Volumen: 141
- Hydrophobizitätsgrad: −1,3
Tyrosin bildet mit einer geeigneten Diazo-Komponente einen roten Azofarbstoff und lässt sich auf diese Weise mit der Pauly-Reaktion qualitativ nachweisen.
In Proteinen
Das L-Tyrosin ist eine proteinogene Aminosäure. Es wird als Baustein für den Aufbau zahlreicher Proteine bei der Translation benötigt.
Eine besondere Bedeutung hat das L-Tyrosin in Proteinen, die an Signaltransduktionsprozessen beteiligt sind. Es fungiert hier als Empfänger von Phosphat-Gruppen, die durch Proteinkinasen übertragen werden und das Zielprotein, eines Rezeptors in seiner Aktivität verändern (siehe Rezeptor-Tyrosinkinasen).
Eine wichtige Rolle spielt L-Tyrosin auch bei der Photosynthese, indem es im Photosystem II als Elektronendonor das oxidierte Chlorophyll reduziert. Es verliert hierbei zunächst das Proton seiner phenolischen OH-Gruppe, wird zu einem neutralen Radikal, und wird dann vom im Photosystem II befindlichen vierkernigen Mangancluster wieder reduziert.
Metabolismus
Biogenese
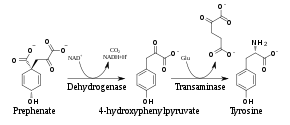
Pflanzen und die meisten Mikroorganismen synthetisieren Tyrosin im Shikimisäureweg über Chorisminsäure. Nach der Umlagerung von Chorismat in Prephenat entsteht mittels einer Prephenatdehydrogenase das 4-Hydroxyphenylpyruvat, aus dem durch Transaminierung unter Wirkung einer Transaminase dann Tyrosin gebildet wird.
Im tierischen Organismus entsteht Tyrosin durch Biopterin-abhängige 4-Hydroxylierung am Phenylring von L-Phenylalanin. Das diese Reaktion katalysierende Enzym ist die Phenylalaninhydroxylase (EC 1.14.16.1), eine Monooxygenase. Dabei wird ein Sauerstoffmolekül (O2) benötigt und bei dieser Reaktion entsteht ein Wassermolekül (H2O). Das Vorprodukt, die essentielle Aminosäure L-Phenylalanin, wird mit der Nahrung aufgenommen.
Infolge einer Phenylketonurie (PKU) kann es zu einem Mangel an L-Tyrosin kommen. Über Nahrung aufgenommenes L-Phenylalanin kann dabei nicht korrekt in der para-Stellung hydroxyliert werden, sodass kein L-Tyrosin aus Phenylalanin gebildet werden kann. In diesem Fall muss L-Tyrosin dem Körper zugeführt werden.

Präkursor
Tyrosin dient als Ausgangsstoff (Präkursor) für die Biosynthese verschiedener anderer Stoffe.
- Die Bildung der Schilddrüsenhormone L-Triiodthyronin (T3) und L-Thyroxin (T4) im Kolloid der Schilddrüse beruht auf Tyrosin-Untereinheiten.
- Die Decarboxylierung durch das Enzym Aromatische-L-Aminosäure-Decarboxylase (AADC) ergibt das biogene Amin Tyramin.
- Eine Hydroxylierung mit Hilfe des Enzyms TyrosinhydroxylaseTyrosinhydroxylase – in Melanozyten häufig über das Enzym Tyrosinase – führt zu DOPA.
DOPA ist wiederum Präkursor für verschiedene Neurotransmitter sowie für Melanin. Im Nebennierenmark ermöglicht die Decarboxylase die Produktion der Katecholamine Adrenalin und Noradrenalin, die als Botenstoffe an das Blut abgegeben werden. Die Produktion von Dopamin aus DOPA erfolgt membranständig in Nervenzellen. Melanin aus DOPA wird insbesondere von Melanocyten der Haut produziert und abgegeben sowie in den Pigmentzellen der Augen, wo es eingelagert bleibt.
Pathophysiologie
Bei nitrosativem Stress wird aus Peroxinitrit und Tyrosin mittels nukleophiler aromatischer Substitution Nitrotyrosin gebildet. Nitrotyrosin dient in der Labordiagnostik als Biomarker für nitrosativen Stress beziehungsweise Apoptose (programmierter Zelltod).
Abbau
Der Abbau von L-Tyrosin (para-Hydroxyphenylalanin) beginnt mit einer α-Ketoglutarat-abhängigen Transaminierung durch die L-Tyrosin-Transaminase (EC 2.6.1.5) zu p-Hydroxyphenylpyruvat.
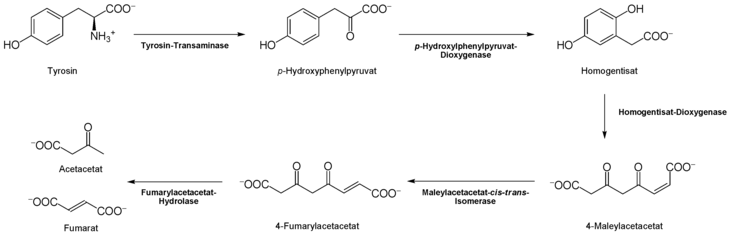
Den nächsten Schritt katalysiert die 4-Hydroxyphenylpyruvat-Dioxygenase (EC 1.13.11.27) unter Einbau von Sauerstoff und Abspaltung von CO2 zum Homogentisat (2,5-Dihydroxyphenyl-1-acetat). Um den aromatischen Ring des Homogentisats zu spalten, wird eine weitere Dioxygenase, die Homogentisat-Oxigenase (EC 1.13.11.5), benötigt. Dabei entsteht durch Einlagerung eines weiteren O2-Moleküls das Maleylacetacetat.
Mit der Maleylacetacetat-cis-trans-Isomerase (EC 5.2.1.2) entsteht in diesem Fall Fumarylacetat durch Rotation der durch Oxidation (aus der Hydroxygruppe) entstandenen Carboxygruppe. Diese cis-trans-Isomerase enthält Glutathion als Koenzym. Fumarylacetacetat kann schließlich durch die Fumarylacetacetat-Hydrolase durch Wassereinlagerung gespalten werden.
Dabei werden Fumarat (auch ein Metabolit des Citrat-Zyklus) und Acetacetat (Butan-(3)-on-Säure) frei. Acetacetat ist ein Ketonkörper, welcher mit Succinyl-CoA aktiviert wird, und danach in zwei Moleküle Acetyl-CoA (für Citratzyklus und Fettsäuresynthese) umgesetzt werden kann.
Anwendungen
Tyrosin ist ein Vorläufer von Neurotransmittern, insbesondere Dopamin und Noradrenalin. Durch vermehrte Zufuhr von Tyrosin kann deren Synthese vorübergehend deutlich gesteigert werden, für etwa eine halbe Stunde. Auf die Stimmungslage hat dies aber nur geringen Einfluss. Der für die Umwandlung im Stoffwechsel geschwindigkeitsbestimmende Schritt wird durch die TyrosinhydroxylaseTyrosinhydroxylase katalysiert und limitiert, weshalb die Effekte geringer als bei Zufuhr von L-DOPA ausfallen. Aus Tierversuchen ist bekannt, dass deren Enzymaktivität bei hohen Dosen von Tyrosin durch Substratüberschusshemmung stark abnimmt, sodass der Dopaminspiegel absinkt.
Einige Studien fanden einen Nutzen unter Stressbelastung, Kälte oder Übermüdung. Eine Steigerung des Leistungsvermögens im Ausdauersport (anderthalbstündiges Radfahren) durch Tyrosinaufnahme konnte nicht festgestellt werden, hingegen durch Kohlenhydrataufnahme.
Die diätetische Zuführung von L-Tyrosin dient als Substitutionstherapie oder Supplementation bei Mangel, so z.B. bei Phenylketonurie, da ansonsten eine Unterproduktion von Melanin (Albinismus) und L-Thyroxin (Kretinismus) resultiert. Zudem können Probleme bei der Herstellung von Katecholaminen bestehen.
Daneben wird L-Tyrosin aufgrund seiner Protein-adsorbierenden Eigenschaften seit Jahren als adjuvanter Depotträger bei der spezifischen Subkutanen Immuntherapie (SCIT) eingesetzt. L-Tyrosin zeichnet sich gegenüber anderen Depotträgern wie Aluminiumhydroxid oder Calciumphosphat dabei unter anderem durch den Vorteil der vollständigen Metabolisierbarkeit und eine geringere Halbwertszeit von 48 Stunden an der Injektionsstelle aus.
Im Schulunterricht kann Tyrosin als Ersatzstoff für giftige Amine gemäß RiSU zur Herstellung von Azofarbstoffen verwendet werden.
Herstellung
Die saure Hydrolyse keratinhaltiger Proteine (Haare, Klauen/Nägel, Federn) ergibt nach der Neutralisation ein Proteinhydrolysat, das aus den etwa 20 proteinogenen α-Aminosäuren besteht. Daraus lässt sich eine L-Cystin- und L-Tyrosin-reiche Fraktion einfach durch Abtrennung der gut wasserlöslichen Aminosäuren gewinnen, da L-Cystin- und L-Tyrosin sich nur wenig in Wasser lösen. L-Tyrosin wird nach dieser einfachen Trennmethode kommerziell gewonnen.
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 5. Auflage. Spektrum Akademischer Verlag, Heidelberg 2003, ISBN 3-8274-1303-6.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 20.12. 2025
