
Peroxinitrit

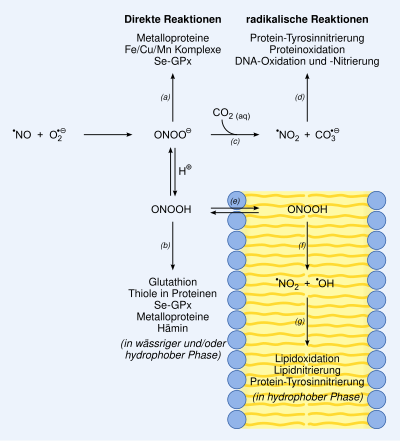
Das Peroxinitrit-Anion (ONOO−) gehört zu den reaktiven Stickstoff- bzw. Sauerstoffverbindungen (RNOS; engl. reactive nitrogen oxide species bzw. ROS; engl. reactive oxygen species). In einem Organismus können diese Verbindungen mit anderen Verbindungen (Proteinen, DNA) reagieren und Schaden verursachen.
Peroxinitrit-Anionen entstehen bei der Rekombination von Stickstoffmonoxid- und Superoxid-Radikalen.
Superoxide und Stickstoffmonoxid (•NO) entstehen im Stoffwechsel kontinuierlich bei vielen verschiedenen Prozessen, beispielsweise der NO-Bildung aus Nitrit, durch die NO-Synthase (NOS), im Rahmen der Immunabwehr, bei der Autooxidation von biologischen Molekülen oder bei Reaktionen der Xanthinoxidase (XO).
Weder Superoxid noch NO sind in vivo toxisch, solange beide nicht in unphysiologisch hohen Konzentrationen oder gemeinsam auftreten. Superoxidradikale werden mittels Superoxiddismutasen (SOD) bzw. Peroxidasen sehr rasch entschärft (O2•− → H2O2 → O2, H2O). NO hingegen reagiert überwiegend mit oxygeniertem Hämoglobin zu Nitraten.
Aufgrund dieser und noch anderer Schutzmechanismen (beispielsweise Glutathion, Ascorbinsäure, Tocopherol) soll die Entstehung noch toxischerer Substanzen verhindert werden. Sollte dies Ausbleiben, können Peroxinitrit-Ionen und Hydroxylradikale (•OH) entstehen.
Hydroxylradikale reagieren aufgrund ihrer hoher Reaktivität sehr rasch mit der nächstgelegenen Verbindung. Peroxinitrite hingegen besitzen eine längere Halbwertszeit und können so selektiver mit Verbindungen reagieren. Sie werden beispielsweise von Makrophagen zur Abwehr von Keimen eingesetzt. Sie sind hochpotente Zellgifte und entstehen durch diffusionskontrollierte Reaktion zwischen NO- und Superoxid-Radikalen (O2•− + •NO → ONOO−). Peroxinitrite entstehen also rasch, wenn NO und Superoxide simultan in größeren Mengen entstehen bzw. nicht ausreichend abgebaut werden können. So kann die Bildung von Peroxinitrit-Ionen unter stark proinflammatorischen Bedingungen um das Einmillionenfache ansteigen. Da Superoxidradikale im Vergleich zum NO-Radikal deutlich schlechter diffundieren und eine geringe Halbwertszeit besitzen, ist die Peroxinitritentstehung primär mit der Entstehung von Superoxidradikalen assoziiert. Peroxinitrit-Ionen selbst können mit einer (physiologischen) Halbwertszeit von rund 10 ms ihre schädigende Wirkung innerhalb von ein bis zwei Zelldurchmessern entfalten.
Peroxinitrite bzw. die daraus entstehenden Radikale können Schäden an Enzymen, dem Erbgut (DNA), den Mitochondrien und Membranen verursachen; Signalkaskaden können verändert beziehungsweise gestört werden; die Formation von Lewy-Körperchen wird begünstigt und letztendlich kann die Apoptose eingeleitet oder Nekrose verursacht werden. Gefäß- und kardiovaskuläre Erkrankungen, Zirkulationsschock, Erkrankungen des Immunsystems, Schmerz, Neurodegeneration, Alterung und anderes sind mit der Peroxinitritentstehung assoziiert.
So reagieren Peroxynitrit-Ionen mit stets vorhandenem Kohlenstoffdioxid zum kurzlebigen Nitrosoperoxycarbonat-Ion, das in zwei hochreaktive Radikale zerfällt, die für die DNA-Schäden von Peroxinitriten verantwortlich sind:
- ONOO− + CO2 → ONOOCOO− → NO2• + CO3•−
Die meisten der zahlreichen endo- und exogenen Peroxinitrit-„Fänger“ bzw. -„Neutralisierer“ interagieren nur mit den sekundär entstehenden Radikalen (beispielsweise mit •OH, •NO2, CO3•−) und besitzen so eine nur eingeschränkte oder geringe Wirksamkeit. Metalloporphyrine hingegen (beispielsweise oxygeniertes Hämoglobin) reagieren direkt und rasch mit Peroxinitrit. Fe(III)-porphyrine inaktivieren Peroxinitrit-Ionen, indem sie sie zu Nitrat-Ionen isomerisieren. Entsprechende Verbindungen werden für die klinische Anwendung entwickelt und scheinen für erwähnte Krankheitsbilder vielversprechende Therapieoptionen zu bieten.
Einzelnachweise
- ↑ Szabó C, Ischiropoulos H, Radi R:
Peroxynitrite: biochemistry, pathophysiology and development of therapeutics. In: Nat Rev Drug Discov.
6. Jahrgang, Nr. 8, August 2007,
S. 662–680,
doi:
 10.1038/nrd2222,
10.1038/nrd2222,
 PMID 17667957
PMID 17667957


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.12. 2024