
Glutathion
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Toxikologische Daten | 5000 mg/kg (LD50, Maus, oral) | ||||||
Glutathion (GSH), auch γ-L-Glutamyl-L-cysteinylglycin, ist ein Tripeptid, das aus den drei Aminosäuren Glutaminsäure, Cystein und Glycin gebildet wird. Es ist in fast allen Zellen in hoher Konzentration enthalten und gehört zu den wichtigsten als Antioxidans wirkenden Stoffen im Körper. Gleichzeitig ist es eine Reserve für Cystein. Es handelt sich bei Glutathion nicht um ein echtes Tripeptid, da die Amidbindung zwischen Glutaminsäure und Cystein über die γ-Carboxygruppe der Glutaminsäure ausgebildet wird und nicht über die α-Carboxygruppe wie bei einer echten Peptidbindung.
Actinobakterien produzieren Mycothiol anstelle von Glutathion.
Biosynthese
| Strukturformel | ||
|---|---|---|
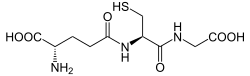
| ||
| Allgemeines | ||
| Name | Glutathion | |
| Andere Namen |
| |
| Summenformel | C10H17N3O6S | |
| Kurzbeschreibung |
weißer Feststoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 200-725-4 | |
| ECHA-InfoCard | ||
| PubChem | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 307,33 g/mol | |
| Aggregatzustand | fest | |
| Schmelzpunkt | 185–195 °C | |
| Löslichkeit | löslich in Wasser (100 g/l bei 20 °C) und Dimethylformamid | |
Glutathion kann vom Körper aus den Aminosäuren L-Glutaminsäure, L-Cystein und Glycin in einem zweistufigen Prozess synthetisiert werden.
- Unter ATP-Verbrauch wird aus Glutaminsäure und Cystein γ-Glutamylcystein gebildet. Dabei wird eine ω-Peptidbindung zwischen der γ-Carboxygruppe des Glutaminsäurerestes mit der Aminogruppe des Cysteinrestes gebildet. Das daran beteiligte Enzym heißt Glutamatcysteinligase (GCL, auch γ-Glutamylcysteinsynthetase).
- Mit Hilfe der Glutathionsynthase wird unter ATP-Verbrauch Glycin an das terminale Kohlenstoffatom addiert.
Alle Zellen des menschlichen Körpers besitzen die Fähigkeit, GSH zu synthetisieren. Dabei ist die Biosynthese des Stoffs in der Leber essentiell: Mäuse mit gestörter Glutathionproduktion in der Leber sterben innerhalb eines Monats nach der Geburt.[1]
Die meisten Eukaryoten sind zur GSH-Synthese fähig, nicht aber etwa Entamoeba und Giardien. Der Biosyntheseweg kommt in einigen Bakterien vor, wie z.B. Cyanobakterien und Proteobakterien, fehlt aber vielen anderen Bakterien. Unter den Archaeen können nur Halobakterien GSH synthetisieren.
Funktion
Cystein-Reserve
Am bekanntesten ist GSH als Hauptstoff des reduktiven Pools. Eine konstante Versorgung mit Cystein ist unentbehrlich für die Proteinsynthese, aber Cystein ist reaktionsfreudig und geht in aerober Umgebung durch Oxidation zu Cysteinsulfin- und -sulfonsäure ständig irreversibel verloren. GSH stellt somit auch eine Notreserve für die Aminosäure Cystein dar. Außerdem wird es zur Taurinsynthese verwendet.
Im menschlichen Blutplasma sind etwa drei Gramm Cystein in Form von GSH enthalten, was einer Reserve für drei Tage entspricht.[2]
Redox-Puffer
GSH kann helfen, zelluläre Makromoleküle wie etwa Proteine und Membranlipide vor „freien Radikalen“ (reaktive Sauerstoffspezies, ROS) zu schützen. Dabei wird Glutathion oxidiert und geht von seiner monomeren Form GSH in ein Dimer GSSG über.
ROS, die u. a. im Verlauf der Zellatmung entstehen können, stellen eine erhebliche Gefahr für zahlreiche Zellbestandteile dar. Reduziertes Glutathion (GSH) besitzt eine freie Thiolgruppe und kann so seinerseits Elektronen auf ROS übertragen und sie so unschädlich machen. Jeweils zwei oxidierte Glutathion-Moleküle verbinden sich unter Ausbildung einer Disulfidbrücke zu einem Glutathion-Disulfid (GSSG). Durch das Enzym Glutathion-Reduktase können aus einem GSSG-Dimer unter Verbrauch von NADPH wieder zwei reduzierte GSH hergestellt werden. Das Redoxpotential von GSH beträgt −240 mV[3] und liegt durch die Aktivität der Glutathion-Reduktase zu 90 % reduziert vor.
Biotransformation
GSH spielt eine wichtige Rolle in Phase II der Biotransformation schädlicher Stoffe. Mit GSH konjugierte Stoffe sind gewöhnlich besser wasserlöslich und können über die Niere ausgeschieden werden. Dabei katalysiert die meist im Zytosol lokalisierte Glutathion-S-Transferase die Reaktion von GSH mit elektrophilem Kohlenstoff. Dabei können Halogen-, Sulfat-, Sulfonat-, Phosphat- und Nitro-Gruppen durch Glutathion substituiert werden. Des Weiteren kann GSH an aktivierte Doppelbindungen addiert werden und reaktive Epoxidringe öffnen. Die toxifizierende (giftende) Wirkung umfasst die Aktivierung von vicinalen Dihaloalkanen unter Bildung eines hochreaktiven Episulfoniumringes sowie eine β-Lyase vermittelte Überführung der GSH-Konjugate in der Niere zu reaktiven Verbindungen.
Weitere Funktionen
In Pflanzen, Nematoden, Algen und Pilzen dient das Glutathion auch als Substrat für die Synthese von Phytochelatinen, die wie Metallothioneine eine wichtige Rolle bei der Bindung von Schwermetallen spielen.
Eine weitere Aufgabe erfüllt Glutathion bei der Synthese bestimmter Leukotriene, wie zum Beispiel bei der Synthese von Leukotrien C4. Aus Leukotrien A4 entsteht mithilfe der Glutathion-S-Transferase Leukotrien C4.
Geschichte
Als Frederick Gowland Hopkins 1921 ein cysteinhaltiges Peptid in Hefe und Tierzellen beschrieb und Glutathion nannte, war man zunächst der Ansicht, es handele sich um γ-Glutamylcystein. Erst Harington und Mead konnten 1935 durch Totalsynthese die später vermutete tatsächliche Struktur bestätigen.[4]
Nahrungsergänzungsmittel
Aufgrund seiner antioxidativen Wirkung wird Glutathion als Nahrungsergänzungsmittel verkauft.[5] Die Bioverfügbarkeit von über die Nahrung zugeführtem Glutathion wird im Allgemeinen als sehr gering eingeschätzt, wurde aber im April 2013 durch eine Studie des Penn State College an 54 Studenten mit positivem Ergebnis untersucht.[6] Parenterale Zufuhr erhöht den GSH-Spiegel in den Zellen.[7] Ein potentieller gesundheitlicher Nutzen Glutathions, beispielsweise als Anti-Krebsmittel[8] oder als Mittel in der Altershemmung[9], muss noch in klinischen Studien weiter untersucht werden. Eine Stimulierung der Glutathionproduktion in der Leber durch Gabe von Acetylcystein (als Cysteindonor) wird in einer Stellungnahme der EFSA aus dem Jahr 2004 mit möglichen gesundheitlichen Risiken bei gesunden Kontrollpersonen in Verbindung gebracht.[10]
Als umstrittenes „Krebsmittel“ wurde Glutathion in einer Mischung mit Anthocyanen unter dem Namen Recancostat comp. verkauften Präparat Mitte der 1990er Jahre bekannt.
Literatur
- Ashley Wilber (Hrsg.): Glutathione: Dietary Sources, Role in Cellular Functions and Therapeutic Effects. Nova Science Publishers, New York 2015, ISBN 978-1-63463-372-7.
Einzelnachweise
- ↑ Y. Chen u. a.: Hepatocyte-specific Gclc deletion leads to rapid onset of steatosis with mitochondrial injury and liver failure. In: Hepatology. 45, 2007, S. 1118
- ↑ David Heber, George L. Blackburn, Vay Liang W. Go, John Milner (Hrsg.): Nutritional Oncology. Academic Press, 2006, ISBN 0-12-088393-7.
- ↑ F. Aslund, K. D. Berndt, A. Holmgren: Redox potentials of glutaredoxins and other thiol-disulfide oxidoreductases
of the thioredoxin superfamily determined by direct protein-protein redox equilibria. In:
J Biol Chem. 272(49), 1997, S. 30780–30786.
 PMID 9388218.
PMID 9388218.
- ↑ C. R. Harington, T. H. Mead: Synthesis of glutathione. In:
Biochem. J. Band 29,
Nr. 7, Juli 1935,
S. 1602–1611,
 PMID 16745829,
PMID 16745829,
 PMC 1266669 (freier Volltext) –
(
PMC 1266669 (freier Volltext) –
( biochemj.org).
biochemj.org).
- ↑ Markus Minoggio: Was der Körper wirklich braucht …: Über Nahrungsergänzungsmittel, Vitamine und Pseudoprodukte. Goldegg Verlag, 2008, ISBN 978-3-901880-16-2.
- ↑
 Research shows
oral supplement increases body’s storage of antioxidant. In: Penn State News. 22. April 2013.
Research shows
oral supplement increases body’s storage of antioxidant. In: Penn State News. 22. April 2013. - ↑ M. K. Robinson, M. S. Ahn, J. D. Rounds, J. A. Cook, D. O. Jacobs, D. W. Wilmore: Parenteral glutathione monoester enhances tissue antioxidant stores. In: JPEN J Parenter Enteral Nutr. 16(5), Sep-Oct 1992, S. 413–418.
- ↑ Ben Pfeifer, Joachim Preiß, Clemens Unger (Hrsg.): Onkologie integrativ: Konventionelle und Komplementäre Therapie. Urban & Fischer Verlag/Elsevier, 2006, ISBN 3-437-56420-X, S. 357–358.
- ↑ P. Kumar, C. Liu, J. Suliburk, J. W. Hsu, R. Muthupillai, F. Jahoor, C. G. Minard, G. E. Taffet, R. V. Sekhar:
Supplementing Glycine and N-Acetylcysteine (GlyNAC) in Older Adults Improves Glutathione Deficiency, Oxidative Stress, Mitochondrial Dysfunction, Inflammation, Physical Function,
and Aging Hallmarks: A Randomized Clinical Trial. In: J. Gerontol. A Biol. Sci. Med. Sci. 78(1), Jan 2023, S. 75–89.
doi:
 10.1093/gerona/glac135.
10.1093/gerona/glac135.
 PMID 35975308.
PMID 35975308.
- ↑
 N-Acetyl-L-cystein zur Verwendung in Lebensmitteln für
besondere Ernährungszwecke sowie in Lebensmitteln für besondere medizinische Zwecke (PDF). EFSA-Gutachten
N-Acetyl-L-cystein zur Verwendung in Lebensmitteln für
besondere Ernährungszwecke sowie in Lebensmitteln für besondere medizinische Zwecke (PDF). EFSA-Gutachten


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 02.10. 2025