
Phosphate
| Phosphate |
 Das Anion PO43− |
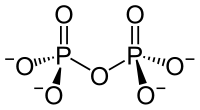 Ein Kondensat: Diphosphat |
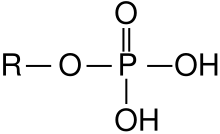 Ein Ester: Phosphorsäureester |
Phosphate sind die Salze und Ester der Orthophosphorsäure (H3PO4).[1] Im weiteren Sinn werden auch die Kondensate (Polymere) der Orthophosphorsäure und ihre Ester Phosphate genannt.[1] Die Ester werden unter Phosphorsäureester beschrieben. Phosphor liegt bei allen diesen Verbindungen in der Oxidationsstufe +5 vor. Sauerstoffverbindungen des Phosphors mit anderen Oxidationsstufen sind unter Phosphor aufgelistet.
Varianten
Primäre, sekundäre und tertiäre Phosphate
Die Salze der dreibasigen ortho-Phosphorsäure (H3PO4) lassen sich in primäre, sekundäre und tertiäre Phosphate einteilen. Bei einwertigen Kationen M′ gelten die Summenformeln entsprechend M′H2PO4, M′2H1PO4 und M′3PO4. Durch die teilweise Neutralisation der Phosphorsäure erhält man Hydrogen- oder Dihydrogenphosphate. Diese können sowohl mit Säuren als auch mit Basen reagieren. Wegen dieser Eigenschaft enthalten viele Pufferlösungen Hydrogenphosphate.
| primäre Phosphate (Dihydrogenphosphate) |
sekundäre Phosphate (Hydrogenphosphate) |
tertiäre Phosphate |
|---|---|---|
| Natriumdihydrogenphosphat, NaH2PO4 | Dinatriumhydrogenphosphat, Na2HPO4 | Natriumphosphat, Na3PO4 |
| Kaliumdihydrogenphosphat, KH2PO4 | Dikaliumhydrogenphosphat, K2HPO4 | Kaliumphosphat, K3PO4 |
| Calciumdihydrogenphosphat, Ca(H2PO4)2 | Calciumhydrogenphosphat, CaHPO4 | Calciumphosphat, Ca3(PO4)2 |
Kondensate
Phosphorsäure kann in einer Kondensationsreaktion (Wasserabspaltung) Diphosphorsäure (H4P2O7) bilden. Analog gibt es entsprechende Salze, die Diphosphate (Pyrophosphate) M'4P2O7. Bei einer fortgesetzten Reaktion bilden sich auch poly- oder cyclo-Phosphate. cyclo-Phosphate werden oft Metaphosphate genannt. Polyphosphate und Metaphosphate sind also Polymere der Salze der Phosphorsäure.
| di-, poly- und cyclo-Phosphate | ||
|---|---|---|
| Name | Reaktion | Struktur des Anions |
| di-Phosphat (auch: Pyrophosphat) |
|

|
| tri-Phosphat (allg.: poly-Phosphat) |
|
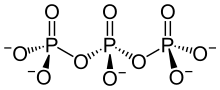
|
| meta-Phosphat (allg.: cyclo-Phosphat) |
|
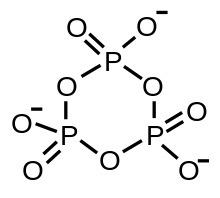
|
Pentanatriumtriphosphat (Na5P3O10) und Metaphosphate wurden zur Wasserenthärtung in Waschmitteln verwendet. Als Lebensmittelzusatzstoffe finden z. B. Pentanatriumtriphosphat und Diphosphate Anwendung.
Gewinnung und Abbau
Phosphate werden aus Mineralen wie zum Beispiel Apatit, Ca5[(PO4)3(OH,F,Cl)], gewonnen. Da Phosphate in vielen verschiedenen Mineralien und in unterschiedlicher Zusammensetzung vorkommen, wird der Phosphorgehalt üblicherweise auf den Gehalt an Phosphorpentoxid (P2O5) umgerechnet angegeben[2]. Die Hauptvorkommen liegen im nördlichen Afrika (Marokko, Westsahara), Jordanien, Vereinigte Staaten (Florida), Russland (Kola-Halbinsel), Südafrika, Togo und China. Früher fanden sich die Phosphatvorkommen mit der höchsten Konzentration (Nauruit, welches aus Guano entstand) auf der Pazifikinsel Nauru. Die ursprünglichen Vorkommen sind seit 2003 erschöpft. 2004 wurden neue Vorkommen auf Nauru erschlossen. Saudi-Arabien ist seit 2006 einer der größten Produzenten weltweit.[3] Anfang 2021 berichtete ein Explorationsunternehmen über den Fund bedeutender Lagerstätten in Norwegen.[4] 2023 wurde bekannt, dass diese norwegische Lagerstätte rund 70 Milliarden Tonnen Phosphat enthält, was in etwa den gesamten bisher bekannten Reserven entspricht und den globalen Phosphatbedarf für 50 Jahre decken könnte.[5]
2020 wurden weltweit 220 Millionen Tonnen Phosphatgestein abgebaut mit einem Phosphatgehalt, der 70 Millionen Tonnen P2O5 entsprach. Größtes Abbauland war China, gefolgt von Marokko, den USA und Russland. Die Ressourcen von Phosphaten wurden 2022 von der USGS auf 300 Milliarden Tonnen geschätzt, die bekannten Reserven betrugen 71 Milliarden Tonnen. Vor allem Jordanien, Marokko und Saudi-Arabien konnten 2021 ihre Produktion steigern. Weitere Ausbauprojekte laufen derzeit in Brasilien, Kasachstan, Mexiko, Russland und Südafrika, werden aber erst nach 2024 den Betrieb aufnehmen können[6] Einige Lagerstätten sind mit Cadmium und/oder radioaktiven Schwermetallen belastet. Manche Phosphatlagerstätten dienten bislang als Quelle für Uran. Der Cadmiumgehalt der Phosphatlagerstätten ist sehr unterschiedlich. Viele Industrieländer haben bereits einen Grenzwert für Cadmium in Düngemitteln eingeführt.
Die früher in den Industrieländern praktizierte Nutzung von Thomasmehl (einem Nebenprodukt der Eisenerz-Verhüttung) ist auf Grund der hohen Chrombelastung aus Gesundheitsgründen ausgeschlossen. Eine weitere Möglichkeit ist, die im Klärschlamm vorhandenen gefällten oder biologisch angereicherten Phosphate zu nutzen oder zurückzugewinnen[8]. In Deutschland und anderen Ländern wird Klärschlamm bisher meist verbrannt, da er häufig zahlreiche Schwermetalle und endokrine Disruptoren enthält.
Da 85 % des in Deutschland verwendeten importierten Phosphats in die Landwirtschaft gehen, könnte ein Teil durch Klärschlamm ersetzt werden[8]. Im Wirtschaftsjahr 2003/2004 lag der Düngemittelabsatz laut den Erhebungen des Statistischen Bundesamtes bei 112.000 Tonnen Phosphor.[9] Dem sollte mit der Novellierung der Klärschlammverordnung 2017 Rechnung getragen werden, wonach „eine Rückgewinnung von Phosphor und eine Rückführung des gewonnenen Phosphors oder der phosphorhaltigen Klärschlammverbrennungsasche in den Wirtschaftskreislauf anzustreben“ ist.[10] Auch in der Schweiz wurden entsprechende Überlegungen angestellt.[11] Die Schweizer Düngeverordnung wurde 2001 entsprechend angepasst und es wurde ein Netzwerk für das Phosphorrecycling aufgebaut, an dem andere europäische Länder ebenfalls beteiligt sind. Inzwischen gibt es sieben entsprechende Pilotanlagen.[12]
Chemische Eigenschaften
Anionen und pH-Werte
In wässriger Lösung existieren Phosphat-Anionen in drei Formen. Unter stark basischen Bedingungen liegt das Phosphat-Anion hauptsächlich als (PO43−) vor, während unter schwach basischen Bedingungen das Hydrogenphosphat-Anion (HPO42−) dominiert. Unter schwach sauren Bedingungen liegt hauptsächlich das Dihydrogenphosphat-Anion (H2PO4−) vor. In stark saurer wässriger Lösung ist Phosphorsäure (H3PO4) die Hauptform.
Es liegen also drei pH-abhängige Gleichgewichtsreaktionen vor:
| Gleichgewichtsreaktionen | Gleichgewichtskonstante bei 25 °C | |
|---|---|---|
| (1) | ||
| (2) | ||
| (3) | ||

| ||
Unter stark alkalischen Bedingungen, wie z. B. bei pH = 13 liegt im Wesentlichen PO43− und HPO42− vor. Ist die Lösung neutral (pH = 7.0) liegen H2PO4− (62 %) und HPO42− (38 %) vor. Bei pH = 7.4 dreht sich das Verhältnis der beiden Komponenten etwa um: 39 % H2PO4− und 61 % HPO42−. Unter stark sauren Bedingungen (pH=1) ist H3PO4 dominierend im Vergleich zu H2PO4−. HPO42− und PO43− sind praktisch abwesend.
Allgemeines
Mit Ausnahme der Alkali- und Ammonium-Verbindungen sind die meisten Phosphate schlecht wasserlöslich.
Phosphate können Verbindungen mit Schwermetallen eingehen. Diese Eigenschaft macht die Verwendung von Phosphaten problematisch, da Phosphate Schwermetalle in Klärschlamm mobilisieren, auswaschbar machen, können.
Zum überwiegenden Teil enthalten Lagerstätten von Phosphatverbindungen auch Schwermetalle, wie z. B. Cadmium und Uran.
Bedeutung für die Ernährung
In der menschlichen Ernährung spielt Phosphat eine wesentliche Rolle im Energiestoffwechsel und im Knochenumbau. Es verbindet sich mit Calcium zum festen Calciumapatit. Der Phosphatspiegel steht im engen Zusammenhang mit dem Calciumspiegel. Die Bedeutung von Phosphat für das Auftreten von Hyperaktivität bei Kindern gilt als widerlegt.[13]
Bestimmte Krankheitsbilder wie beispielsweise chronische Niereninsuffizienz (auch bei Dialysebehandlung), Osteoporose und Urolithiasis (Calciumphosphatsteine) bedürfen jedoch einer phosphatarmen Ernährung.[14][15]
Verwendung
Dünger
Die Hauptmenge der Phosphate kommt als Dünger zum Einsatz (Phosphatdünger, Superphosphat, Doppelsuperphosphat).[16] Die Eignung von Phosphaten für die Düngung wurde durch Zufall entdeckt: bei der Eisen- und Stahlerzeugung nach dem Thomas-Verfahren fiel als Nebenprodukt das phosphatreiche Thomasmehl an, das sich als hervorragender Dünger erwies.
Durch Erosion von landwirtschaftlichen Flächen gelangen Phosphate an Tonminerale gebunden in Flüsse und Seen und von dort weiter in die Meere. In limnischen als auch marinen Ökosystemen tragen sie erheblich zur Eutrophierung bei. Phosphate sind unter anderem ein Auslöser von Blaualgenblüten (Cyanobakterien) in der Ostsee.
Waschmittelzusatz
Zur Enthärtung von Wasser kann Pentanatriumtriphosphat verwendet werden. Auf den Einsatz von Phosphaten in Waschmitteln wird in Teilen Europas inzwischen verzichtet, da sie zu einer Überdüngung und schließlich zum Umkippen von Gewässern geführt haben. Als Ersatz wird hierzu Zeolith A eingesetzt. In Maschinengeschirrspülmitteln werden allerdings immer noch Tripolyphosphate als Enthärter verwendet.[17] Tests der Stiftung Warentest im Jahr 2015 und 2016 haben gezeigt, dass einige phosphatfreie Spülmaschinentabs bereits eine vergleichbar gute Reinigungswirkung erzielen wie phosphathaltige Mittel.[18][19] Die Detergenzienverordnung (EG) Nr. 648/2004 schreibt durch die Änderungsverordnung (EU) Nr. 259/2012 im Anhang VIa vor, dass ab dem 1. Januar 2017 nur noch Maschinengeschirrspülmittel für Privatverbraucher in den Verkehr gebracht werden dürfen, die weniger als 0,3 Gramm Phosphor pro Standarddosierung enthalten.[20][21]
Lebensmittelzusatzstoff
Natriumphosphat (E 339), Kaliumphosphat (E 340), Calciumphosphat (E 341), Magnesiumphosphate (E 343) und die Salze der ortho-Phosphorsäure Diphosphat (E 450), Triphosphat (E 451) und Polyphosphat (E 452) sind als Lebensmittelzusatzstoffe zugelassen und werden als Konservierungsmittel, Säuerungsmittel, Säureregulator, als Trennmittel und Emulgator eingesetzt. Phosphat wird für nichtalkoholische, aromatisierte Getränke (Colagetränke; in diesen auch als Phosphorsäure (E 338)), sterilisierte und ultrahocherhitzte Milch, eingedickte Milch, Milch- und Magermilchpulver und als technischer Hilfsstoff (verhindert das Zusammenklumpen von rieselfähigen Lebensmitteln) verwendet. Phosphate spielen auch bei der Lebensmittelherstellung (vor allem in der Fleischindustrie) eine sehr große Rolle und sind Komponenten des Schmelzsalzes für Schmelzkäse.
Eine erhöhte Phosphatzufuhr über die Nahrung steigert den Blutdruck und die Pulsrate auch bei gesunden jungen Erwachsenen.[22][23]
Sonstige Verwendungen
Futtermittel, Korrosionsschutzmittel (siehe Phosphatierung); Flammschutzmittel; Puffersubstanz für neutralen pH-Bereich (s.o.), Akkumulatoren (Lithium-Eisenphosphat-Akkumulator).
32P, ein radioaktives Isotop des Phosphors, wird in Form von Dihydrogenphosphat (oder Natriumphosphat) vielseitig in der Forschung und in der nuklearmedizinischen Therapie speziell bei Polycythaemia vera eingesetzt (Radiophosphortherapie).
Umweltbelastung durch Phosphate
In Gewässern führen Phosphate zu einer unnatürlichen Nährstoffanreicherung (Eutrophierung). Infolgedessen kommt es zur starken Vermehrung von Algen. Sterben diese ab, sinkt der Sauerstoffgehalt des Wassers schlagartig, was zum Absterben auch aller anderen Organismen des Gewässers führt (Gewässer kippt um). Nach der europäischen Wasserrahmenrichtlinie müssen alle Gewässer bis 2027 einen guten ökologischen Zustand erreichen. In Deutschland haben zwei Drittel aller Gewässer dafür zu hohe Phosphatgehalte.[24] An mehr als der Hälfte aller Messtellen an deutschen Flüssen werden zu hohe Phosphatgehalte festgestellt.[24] Die Phosphate können durch Abwasser in Gewässer gelangen. Deshalb treiben Kläranlagen einen hohen Aufwand, um Phosphat aus dem Abwasser zu entfernen. Zum Anderen schwemmt Niederschlagswasser Phosphat von den landwirtschaftlichen Flächen in die umgebenden Gewässer. Nach der Düngeverordnung dürfen in Deutschland keine Gülle oder phosphathaltige Dünger auf Böden ausgebracht werden, die nach der vorausgegangenen Bodenuntersuchung bereits hohe Phosphatgehalte aufweisen.[24]
Da der Rohstoff weltweit knapp wird, greift man auf qualitativ immer schlechtere Vorkommen zurück. So ist das Phosphatmineral aus der Westsahara stark mit Cadmium belastet. Durch den Import nach Europa kam es in der Vergangenheit bereits zu erheblichen Belastungen europäischer Ackerflächen mit dem giftigen Schwermetall. Gerade bei der sonst so gesunden pflanzlichen Ernährung haben Menschen ein hohes Risiko, die empfohlenen Grenzwerte für Cadmium zu überschreiten.[25]
Geopolitische Bedeutung
Phosphatmineralien stammen weltweit zu 80 % aus den Staaten Marokko, China, USA und Russland. Auch dort sind die Vorräte in den Lagerstätten begrenzt. Unter den gegenwärtigen Bedingungen geht man davon aus, dass die Vorkommen in 150 bis 300 Jahren erschöpft sein werden. Für die Versorgung der Europäischen Union stellt sich in der Zukunft die Frage der politischen Stabilität der Herkunftsländer und die möglicher Preisanstiege für den knapper werdenden Rohstoff. Phosphat wird deshalb von der deutschen Bundesregierung als kritische Ressource angesehen. Besondere Bedeutung erlangen Verfahren zur Rückgewinnung und zur sparsamen Verwendung. In der Schweiz und Deutschland ist die Rückgewinnung von Phosphor aus dem Klärschlamm gesetzlich geregelt (Klärschlammverordnung).[25]
Nachweis
Nachweisreaktionen von Phosphaten werden unter Phosphor beschrieben.
Einzelnachweise
- ↑ Hochspringen nach: a b Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie. Spektrum Akademischer Verlag, Heidelberg, 2001.
- ↑ D. Montag:
 Phosphorrückgewinnung bei der
Abwasserreinigung: Entwicklung eines Verfahrens zur Integration in kommunale Kläranlagen, S. 4
Phosphorrückgewinnung bei der
Abwasserreinigung: Entwicklung eines Verfahrens zur Integration in kommunale Kläranlagen, S. 4
- ↑ Ma’aden Phosphate Development (Saudi Arabian Mining Company). Worley Parsons.
- ↑
 Norge Mining findet
wohl weltgrößtes Phosphatvorkommen in Norwegen - Update. Abgerufen am 8. Februar 2026.
Norge Mining findet
wohl weltgrößtes Phosphatvorkommen in Norwegen - Update. Abgerufen am 8. Februar 2026.
- ↑ Rune Weichert:
 70 Milliarden Tonnen: Was der Rekordfund von Phosphat in Norwegen bedeutet. 7. Juli 2023,
abgerufen am 8. Februar 2026.
70 Milliarden Tonnen: Was der Rekordfund von Phosphat in Norwegen bedeutet. 7. Juli 2023,
abgerufen am 8. Februar 2026.
- ↑
 Phosphate. In:
United States Geological Survey Mineral Commodity Summaries. 2022
Phosphate. In:
United States Geological Survey Mineral Commodity Summaries. 2022
- ↑
 World Mining Data 2022.
Bundesministerium für Landwirtschaft, Regionen und Tourismus.
World Mining Data 2022.
Bundesministerium für Landwirtschaft, Regionen und Tourismus.
- ↑ Hochspringen nach: a b
 Phosphor-Recycling aus Klärschlamm. In: RiffReporter. 9. März 2021, abgerufen am 8. Februar 2026.
Phosphor-Recycling aus Klärschlamm. In: RiffReporter. 9. März 2021, abgerufen am 8. Februar 2026.
- ↑
 Forschungsbericht zu Phosphorgewinnung aus Klärschlamm im Auftrag des Umweltbundesamtes, Seite 37
Forschungsbericht zu Phosphorgewinnung aus Klärschlamm im Auftrag des Umweltbundesamtes, Seite 37
- ↑ siehe Klärschlammverordnung
 § 3 Absatz 1 Satz 2
§ 3 Absatz 1 Satz 2
- ↑ Bundesamt für Umwelt, BAFU 2009:
 Rückgewinnung von Phosphor aus der Abwasserreinigung
Rückgewinnung von Phosphor aus der Abwasserreinigung
- ↑ Aktuelles aus dem
 Phosphorrecycling Schweiz
Phosphorrecycling Schweiz
- ↑ Manfred Döpfner:
 Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS).
Hogrefe Verlag, 2013, ISBN 978-3-8409-1939-8 (eingeschränkte Vorschau in der Google-Buchsuche).
Aufmerksamkeitsdefizit-/Hyperaktivitätsstörung (ADHS).
Hogrefe Verlag, 2013, ISBN 978-3-8409-1939-8 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ E. Lückerath u. a.: Diätetik und Ernährungsberatung: Das Praxisbuch. Georg Thieme Verlag, 2011, S. 272, ISBN 3-8304-7563-2,
 eingeschränkte Vorschau in der Google-Buchsuche.
eingeschränkte Vorschau in der Google-Buchsuche.
- ↑ R. Nowack u. a.: Dialyse und Nephrologie für Pflegeberufe. Springer, 2002, S. 292, ISBN 3-540-42811-9,
 eingeschränkte Vorschau in der Google-Buchsuche.
eingeschränkte Vorschau in der Google-Buchsuche.
- ↑
 Phosphorverbrauch in Deutschland und Europa. In:
RiffReporter. 12. Februar 2021, abgerufen am 8. Februar 2026.
Phosphorverbrauch in Deutschland und Europa. In:
RiffReporter. 12. Februar 2021, abgerufen am 8. Februar 2026.
- ↑
 Phosphate in Geschirrspülmitteln. IDW-Online, 26. Januar 2012.
Phosphate in Geschirrspülmitteln. IDW-Online, 26. Januar 2012.
- ↑
 Spülmaschinen-Tabs im Test der Stiftung Warentest In: test, 5/2015, S. 62–66 und test.de vom 23. April 2015.
Spülmaschinen-Tabs im Test der Stiftung Warentest In: test, 5/2015, S. 62–66 und test.de vom 23. April 2015.
- ↑
 Geschirrspülmittel: Die Phosphatfreien können‘s jetzt auch! In: test, 8/2016, S. 71–75 und test.de vom 5. Oktober 2016.
Geschirrspülmittel: Die Phosphatfreien können‘s jetzt auch! In: test, 8/2016, S. 71–75 und test.de vom 5. Oktober 2016.
- ↑ EU:
 Bericht der Kommission an das
Europäische Parlament und den Rat gemäß Artikel 16 der Verordnung (EG) Nr. 648/2004 des Europäischen Parlaments und des Rates vom 31. März 2004 über Detergenzien betreffend die Verwendung von Phosphaten in für den
Verbraucher bestimmten Maschinengeschirrspülmitteln, 29. Mai 2015.
Bericht der Kommission an das
Europäische Parlament und den Rat gemäß Artikel 16 der Verordnung (EG) Nr. 648/2004 des Europäischen Parlaments und des Rates vom 31. März 2004 über Detergenzien betreffend die Verwendung von Phosphaten in für den
Verbraucher bestimmten Maschinengeschirrspülmitteln, 29. Mai 2015.
- ↑ EU:
 Verordnung (EU) Nr. 259/2012
des europäischen Parlaments und des Rates vom 14. März 2012 zur Änderung der Verordnung (EG) Nr. 648/2004 in Bezug auf die Verwendung von Phosphaten und anderen Phosphorverbindungen in für den Verbraucher bestimmten
Waschmitteln und Maschinengeschirrspülmitteln, 30. März 2012.
Verordnung (EU) Nr. 259/2012
des europäischen Parlaments und des Rates vom 14. März 2012 zur Änderung der Verordnung (EG) Nr. 648/2004 in Bezug auf die Verwendung von Phosphaten und anderen Phosphorverbindungen in für den Verbraucher bestimmten
Waschmitteln und Maschinengeschirrspülmitteln, 30. März 2012.
- ↑
 Erhöhte Phosphatzufuhr steigert den Blutdruck bei gesunden Erwachsenen. In:
Universität Basel 23. August 2018, abgerufen am 8. Februar 2026.
Erhöhte Phosphatzufuhr steigert den Blutdruck bei gesunden Erwachsenen. In:
Universität Basel 23. August 2018, abgerufen am 8. Februar 2026.
- ↑ Jaber Mohammad, Roberto Scanni, Lukas Bestmann, Henry N. Hulter, Reto Krapf:
A Controlled Increase in Dietary Phosphate Elevates BP in Healthy Human Subjects. In: Journal of the American Society of Nephrology. 29, 2018, S. 2089,
doi:
 10.1681/ASN.2017121254.
10.1681/ASN.2017121254.
- ↑ Hochspringen nach: a b c Indikator: Eutrophierung von Flüssen durch Phosphor. Umweltbundesamt, 4. November 2016, abgerufen am 8. Februar 2026.
- ↑ Hochspringen nach: a b Sonja Kind:
 Nachhaltige Phosphorversorgung. (PDF) Büro für Technikfolgen-Abschätzung beim Deutschen Bundestag,
April 2020, abgerufen am 8. Februar 2026.
Nachhaltige Phosphorversorgung. (PDF) Büro für Technikfolgen-Abschätzung beim Deutschen Bundestag,
April 2020, abgerufen am 8. Februar 2026.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 24.02. 2026