Diphosphorsäure
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Diphosphorsäure (auch Pyrophosphorsäure) ist eine Oxosäure des Phosphors und gehört zu den anorganischen Säuren.
Die Salze und Ester der Diphosphorsäure werden Diphosphate oder Pyrophosphate genannt.
| Strukturformel | |
|---|---|
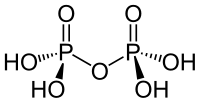
| |
| Allgemeines | |
| Name | Diphosphorsäure |
| Andere Namen | Pyrophosphorsäure |
| Summenformel | H4P2O7 |
| Kurzbeschreibung | weißer bis hellgelber Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 2466-09-3 |
| EG-Nummer | 219-574-0 |
| ECHA-InfoCard | 100.017.795 |
| PubChem | 1023 |
| ChemSpider | 996 |
| DrugBank | DB04160 |
| Eigenschaften | |
| Molare Masse | 177,98 g/mol |
| Aggregatzustand | fest |
| Schmelzpunkt | 61 °C |
| pKS-Wert |
|
| Löslichkeit | sehr gut in Wasser (7090 g/l bei 23 °C) |
Gewinnung und Darstellung
Sie leitet sich von der Phosphorsäure ab und lässt sich als Zusammenlagerung zweier Phosphorsäuremoleküle unter Abspaltung von Wasser darstellen.
Diphosphorsäure wird entsprechend obiger Formel durch Dehydratisierung von Phosphorsäure bei 200–300 °C hergestellt. Reine Diphosphorsäure entsteht aus Phosphorsäure und Phosphoroxychlorid:
Eigenschaften
Diphosphorsäure ist stark hygroskopisch und eine mittelstarke anorganische Säure. Mit Wasser hydrolysiert Diphosphorsäure exotherm zu Phosphorsäure.
Die Pyrophosphorsäure ist die einzige von den linearen Polyphosphorsäuren, die leicht in kristalliner Form erhalten werden kann. Sie besitzt einen theoretischen Diphosphorpentoxid-Gehalt von 79,8 %. Bringt man eine flüssige Säure mit dieser Konzentration zum kristallisieren, erhält man Pyrophosphorsäure (Form I), die gewöhnliche Form (Schmelztemperatur 54,3 °C), als weißen Festkörper. Wird die kristalline Form I in einem abgeschlossenen Rohr mehrere Stunden auf 50 °C erhitzt, dann erfolgt eine Umwandlung in eine Form II (Schmelztemperatur 71,5 °C), die bei Raumtemperatur die stabile Form ist.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 19.05. 2025

