
Fumarsäure
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Toxikologische Daten | |||||||||
Fumarsäure ist der Trivialname einer in der Natur vorkommenden organisch-chemischen Substanz. Die ungesättigte Dicarbonsäure trägt den IUPAC-Namen (E)-Butendisäure und wird auch trans-Butendisäure oder Acidum Fumaricum genannt. Ihre Salze heißen Fumarate. Die isomere Z-Form heißt Maleinsäure.
| Strukturformel | ||
|---|---|---|
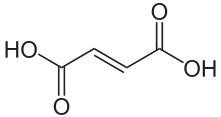
| ||
| Allgemeines | ||
| Name | Fumarsäure | |
| Andere Namen | ||
| Summenformel | C4H4O4 | |
| Kurzbeschreibung | farblose, geruchlose Kristalle | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 203-743-0 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Arzneistoffangaben | ||
| ATC-Code | ||
| Eigenschaften | ||
| Molare Masse | 116,07 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,64 g/cm3 (20 °C) | |
| Schmelzpunkt | 287 °C (geschlossene Kapillare) | |
| Sublimationspunkt | 200 °C | |
| Dampfdruck | < 0,1 Pa | |
| pKS-Wert |
| |
| Löslichkeit | schlecht in Wasser (4,9 g/l bei 20 °C) | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −811,7 kJ/mol | |
Geschichte
Die Verbindung wurde von dem Apotheker Ferdinand Ludwig Winckler erstmalig aus Fumaria officinalis isoliert und beschrieben. Im Jahre 1937 erhielt Albert Szent-Györgyi den Medizin-Nobelpreis für seine biochemischen Arbeiten unter anderem auch zur Fumarsäure.
Vorkommen und Herstellung
Fumarsäure kommt in größeren Mengen in verschiedenen Pflanzen, Pilzen und Flechten vor. Ihren Namen erhielt sie vom Gewöhnlichen Erdrauch (Fumaria officinalis), der größere Mengen der Säure enthält.

Synthetisch wird Fumarsäure durch Isomerisierung aus Maleinsäure hergestellt. Dies geschieht durch Erhitzen auf über 150 °C, durch UV-Bestrahlung oder katalytisch in wässriger Lösung.
Sie entsteht in allen Organismen (z.B. in mehreren Gattungen der Mucorales) auf verschiedenen biochemischen Stoffwechselwegen:
- als Zwischenprodukt im Citratzyklus durch Oxidation der Bernsteinsäure in Gegenwart des Enzyms Succinatdehydrogenase (einer Oxidoreduktase)
- im Harnstoffzyklus durch Spaltung der Argininbernsteinsäure
- in der Biosynthese von Purinnukleotiden (aus Aspartat)
- im Nukleotidstoffwechsel bei der Darstellung von Adenosinmonophosphat aus Inosinmonophosphat
- durch hydrolytischen Abbau von Aminosäuren wie Phenylalanin, Tyrosin
- durch Desaminierung von Asparaginsäure
Eigenschaften
Fumarsäure hat unter Normaldruck keinen Schmelzpunkt, sondern sublimiert ab etwa 200 °C. Sie bildet bei Raumtemperatur weiße, fast geruchlose, brennbare Kristalle. Die wässrige Lösung reagiert stark sauer: 1 l Wasser mit darin gelösten 4,9 g Fumarsäure hat einen pH-Wert von 2,1. Die zweiprotonige Säure hat einen pKs1 von 3,0 und einen pKs2 von 4,5. Die Verbindung löst sich nur wenig in Wasser. Bei 15,5 °C lösen sich in 100 g Wasser nur 0,428 g Fumarsäure, bei 100 °C steigt die Löslichkeit auf 9,97 g pro 100 g Wasser. Der Flammpunkt von Fumarsäure liegt bei 273 °C, die Zersetzungstemperatur bei > 350 °C und die Zündtemperatur bei 375 °C.
Verwendung
Fumarsäure ist als Lebensmittelzusatzstoff E 297 zugelassen und dient als Säuerungsmittel. In der Synthesechemie wird es für die Polyester-Herstellung verwendet. In der Biotechnologie wird Ammoniak stereoselektiv an die Kohlenstoff-Kohlenstoff-Doppelbindung angelagert, es bildet sich enzymkatalysiert L-Asparaginsäure. Viele – insbesondere aminogruppenhaltige – pharmazeutisch wirksame Substanzen werden als Salze der Fumarsäure verabreicht. Fumarsäureester wie Fumarsäuredimethylester und Fumarsäuremonoethylester werden zur Behandlung der Schuppenflechte sowie seit März 2013 der schubförmig-remittierenden multiplen Sklerose eingesetzt.
In der Schweineaufzucht nutzt man Fumarsäure als Futterzusatz für Ferkel, um colibedingten Infektionen vorzubeugen, indem damit der pH-Wert im Darm ausreichend niedrig gehalten wird.
Es konnte nachgewiesen werden, dass Fumarsäure als Futterzusatz bei Lämmern deren Methanproduktion um bis zu 70 % senken kann.
Fumarsäure wird auch in Kosmetikartikeln eingesetzt. Sie findet dort als Puffersubstanz Verwendung und stabilisiert den pH-Wert des Kosmetikums.
Literatur
- K. Lohbeck, H. Haferkorn, W. Fuhrmann, N. Fedke: Maleic and Fumaric Acids. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2012.
doi:
 10.1002/14356007.a16_053.
10.1002/14356007.a16_053.
- Marina Bährle-Rapp: Aleurites moluccana. In: Springer Lexikon Kosmetik und Körperpflege. 4. Auflage. Springer, 2012, ISBN 978-3-642-24688-3.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025
