
Maleinsäure
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Maleinsäure ist der Trivialname für cis-Butendisäure (auch cis-Ethylendicarbonsäure oder Toxilsäure genannt), eine Dicarbonsäure. Ihre Salze heißen Male(in)ate. Die isomere trans-Form heißt Fumarsäure.
Geschichte
Maleinsäure wurde erstmals im Jahre 1834 von Théophile-Jules Pelouze durch das Erhitzen von Äpfelsäure erhalten. Industriell zugänglich wurde die Verbindung ab 1919 durch die von der US-Firma Barrett Co. eingeführte katalytische Gasphasenoxidation von Benzol. Der Name „Maleinsäure“ leitet sich von der Äpfelsäure (Apfel = lat. „malum“) ab.
1874 wurde die räumliche Struktur aus dem chemischen Verhalten – der Anhydridbildung – abgeleitet.
| Strukturformel | ||
|---|---|---|
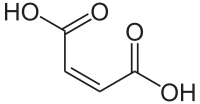 | ||
| Allgemeines | ||
| Name | Maleinsäure | |
| Andere Namen |
| |
| Summenformel | C4H4O4 | |
| Kurzbeschreibung | weißes, kristallines Pulver mit schwach säuerlichem Geruch | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 110-16-7 | |
| EG-Nummer | 203-742-5 | |
| ECHA-InfoCard | 100.003.403 | |
| PubChem | 444266 | |
| ChemSpider | 392248 | |
| DrugBank | DB04299 | |
| Eigenschaften | ||
| Molare Masse | 116,07 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,59 g/cm3 | |
| Schmelzpunkt |
| |
| pKS-Wert | 1,9 und 6,5 | |
| Löslichkeit |
| |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −789,4 kJ/mol | |
Gewinnung und Darstellung
Maleinsäure wird technisch durch Hydratisierung von Maleinsäureanhydrid bei Temperaturen von 65–85 °C hergestellt.
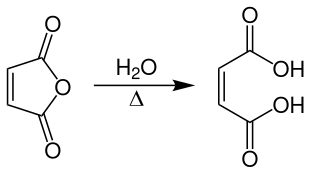
Man arbeitet kontinuierlich in einem Rührkesselreaktor und hält die Temperatur in einem konstanten Bereich. Dadurch kann die Bildung der isomeren Fumarsäure auf weniger als 0,1 % reduziert werden.
Eigenschaften
Physikalische Eigenschaften
Maleinsäure bildet bei Raumtemperatur farblose Kristalle. Beim Erhitzen wird oberhalb von 135 °C eine Zersetzung beobachtet. Sie ist in Wasser sehr gut löslich, wobei die Löslichkeit mit steigender Temperatur stark ansteigt. Wässrige Lösungen der Verbindung sind stark sauer: die zweiprotonige Säure besitzt einen pKs1 von 1,9 und einen pKs2 von 6,5.
| Löslichkeit von Maleinsäure in 100 g Wasser | ||||||||||||
| Temperatur | in °C | 25 | 40 | 60 | 97,5 | |||||||
| Löslichkeit | in g pro 100 g | 78,9 | 112,3 | 148,8 | 392,6 | |||||||
Die molare Bildungsenthalpie beträgt −788,3 kJ/mol, die Verbrennungswärme −1358,9 kJ/mol. Für die Wärmekapazität wurde bei 21 °C ein Wert von 135,6 J·mol−1·K−1 bzw. 1,17 J·g−1·K−1 bestimmt.
Chemische Eigenschaften
Maleinsäure ist chemisch sehr reaktiv hinsichtlich von Reaktionen der Carbonylfunktionen sowie der Doppelbindung. Beim Erhitzen auf Temperaturen oberhalb 100 °C geht sie unter Wasserabspaltung in Maleinsäureanhydrid über. Das Anhydrid bildet beim Auflösen in Wasser dann wieder Maleinsäure. Bei weiterem Erhitzen und mittels Katalysatoren kann eine Decarboxylierung zur Acrylsäure erreicht werden. Bei längerem Erhitzen auf 150 °C sowie bei UV-Bestrahlung isomerisiert die Maleinsäure zur stabileren Fumarsäure. Mit Maleinsäure können alle typischen Carbonylreaktionen wie Veresterungen oder Aminierungen durchgeführt werden. Es wird allerdings kein Säurechlorid gebildet. Eine Addition von Wasser an die Doppelbindung bei erhöhter Temperatur und erhöhtem Druck ergibt die Äpfelsäure, die Addition von Halogenen Dihalogenbernsteinsäuren, eine katalytische Hydrierung die Bernsteinsäure. Durch die Umsetzung mit Ozon wird Glyoxylsäure erhalten. Bei schnellem Erhitzen von Äpfelsäure auf 250 °C spaltet diese 2 Moleküle Wasser ab, wobei Maleinsäureanhydrid entsteht.
Physiologische Eigenschaften
Maleinsäure und ihre Salze sind bei oraler Aufnahme höherer Dosen nierenschädigend. Diese Eigenschaft wird beispielsweise im Tiermodell Farbratte genutzt, um die Symptome des De-Toni-Fanconi-Syndroms hervorzurufen. Dabei werden gezielt die Proximalen Tubuluszellen geschädigt. Die zur Induktion der Nierenfunktionsstörung notwendigen Dosen liegen im Bereich von 200 mg/kg Körpergewicht bei intraperitonealer Gabe.
Verwendung
Maleinsäure wird zur Herstellung von Polymeren, Kunstharzen und Maleinsäureestern, zur Veredelung und beim Färben von Baumwolle sowie als Inhaltsstoff von Entkalkungsmitteln auf der Basis von Amidosulfonsäure oder Citronensäure eingesetzt, welcher einer schnellen Wiederverkalkung entgegenwirken soll.
In der Pharmakologie dienen Lösungen der Maleate von Antihistaminen als injizierbare Medikamente für den akuten Einsatz. In der präparativen Chemie wird Maleinsäure häufig als Agens für Diels-Alder-Reaktion benutzt.
In der Zahnmedizin wird Maleinsäure in selbstätzenden Adhäsivsystemen verwendet, um Dentin zu konditionieren.
Maleat: Verwechslungsgefahr mit Malonat und Malat
Maleat darf nicht mit dem Säureanion der Äpfelsäure, dem Malat-Ion, oder dem Anion der Malonsäure, dem Malonat verwechselt werden.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 01.09. 2024
