Buttersäure
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Buttersäure ist der Trivialname der Butansäure, einer Carbonsäure und gleichzeitig der einfachsten Fettsäure. Sie entsteht in der Natur durch Buttersäuregärung. Ihre Dämpfe reizen die Augen sowie die Atemwege. Die Salze (siehe unten) und Ester (Buttersäureester) der Buttersäure heißen Butyrate (systematisch auch Butanoate). Ihr Isomer ist die Isobuttersäure.
| Strukturformel | ||
|---|---|---|
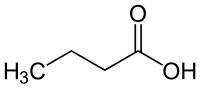 | ||
| Allgemeines | ||
| Name | Buttersäure | |
| Andere Namen | ||
| Summenformel | C4H8O2 | |
| Kurzbeschreibung | farblose, unangenehm riechende Flüssigkeit | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 107-92-6 | |
| EG-Nummer | 203-532-3 | |
| ECHA-InfoCard | 100.003.212 | |
| PubChem | 264 | |
| ChemSpider | 259 | |
| DrugBank | DB03568 | |
| Eigenschaften | ||
| Molare Masse | 88,11 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 0,9528 g/cm3 (25 °C) | |
| Schmelzpunkt | −5 – 6 °C | |
| Siedepunkt | 163,7 °C | |
| Dampfdruck |
| |
| pKs-Wert | 4,82 | |
| Löslichkeit | mischbar mit Wasser, Ethanol und Diethylether | |
| Brechungsindex | 1,3980 (20 °C) | |
Geschichte
Die Buttersäure wurde 1814 von Eugène Chevreul unter den Verseifungsprodukten der Butter entdeckt und sorgfältig beschrieben. Die Herkunft aus dem Butterfett und der Geruch nach Butter (lateinisch butyrum) führten zum Namen der Säure. Théophile-Jules Pelouze beschrieb 1843 sie und ihre Reaktionen genauer und nannte dabei folgende Eigenschaften:
„Die Buttersäure ist eine vollkommen farblose Flüssigkeit, durchsichtig, in hohem Grade beweglich, sie besitzt einen Geruch, welcher gleichzeitig an Essigsäure und kräftige Butter erinnert. Sie ist in allen Verhältnissen, im Wasser, im Alkohol und Holzgeist löslich. Bei gewöhnlicher Temperatur siedet sie bei 164 °C und destilliert ohne bemerkliche Veränderung. Ihr Dampf ist entzündlich und brennt mit blauer Flamme […] ihr Geschmack ist stark sauer und brennend. Sie greift die Haut an und zerstört sie, wie die stärksten Säuren.“
Eigenschaften
Buttersäure macht im Wesentlichen den unangenehmen Geruch von Erbrochenem oder von ranziger Butter aus. Buttersäure trägt auch zum Schweißgeruch und in manchen Fällen zum Mundgeruch bei. Die Dämpfe reizen die Augen und die Atemwege. Buttersäure entsteht beim Ranzigwerden von Butter. Sie löst sich sehr gut in Wasser und auch in Ethanol, Diethylether und Glycerin. Buttersäure ist im Vergleich zur Ameisensäure und Essigsäure eine schwächere Säure. Eisen, Zink, Magnesium und andere unedle Metalle lösen sich unter Wasserstoffentwicklung ganz langsam auf. Dabei bilden sich Butyrate, die bei Feuchtigkeit ebenfalls nach Buttersäure riechen:
- Reaktion von Magnesium mit Buttersäure
Mit Alkoholen können Ester erzeugt werden. Für diese Reaktion ist Wärme und ein Katalysator wie z. B. Schwefelsäure notwendig:
- Reaktion von Buttersäure mit Ethanol
Buttersäure bildet bei erhöhter Temperatur entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei 72 °C. Der Explosionsbereich liegt zwischen 2,0 Vol.‑% (72 g/m³) als untere Explosionsgrenze (UEG) und 10,0 Vol.‑% (365 g/m³) als obere Explosionsgrenze (OEG). Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von 64 °C. Die Zündtemperatur beträgt 440 °C. Der Stoff fällt somit in die Temperaturklasse T2.
Vorkommen
Da die Buttersäure unter anaeroben Bedingungen durch Buttersäurebakterien aus Kohlenhydraten gebildet wird, kommt sie in Lebensmitteln vor, zu deren Zubereitung Gärprozesse notwendig sind, also z.B. Käse, Sauerkraut, Bier und Brot; sie kommt auch in Milch, Fleischsaft und Schweiß, sowie in Holzessig vor. Sie kommt auch in einigen Pflanzenlipiden, meistens in geringer Konzentration vor. Die ursprüngliche Annahme, dass die übelriechende, scharfe und ätzende Flüssigkeit, die verschiedene Arten der Laufkäfer (Carabidae) wie die Echten Laufkäfer (Carabus spp.) zur Abwehr aus der Pygiadialdrüse versprühen, Buttersäure enthält, wurde in späteren Untersuchungen relativiert.
Herstellung

Das grampositive, anaerobe, sporenbildende Bakterium Clostridium tyrobutyricum, ist in der Lage, durch Fermentation Buttersäure zu produzieren. Es hat die Fähigkeit, sowohl Glucose als auch Xylose abzubauen. Die wichtigsten metabolischen Endprodukte sind Buttersäure, Essigsäure, Wasserstoff und Kohlenstoffdioxid. Die vereinfachte Reaktionsgleichung lautet:
Die Ausbeute in Fermentationen ist jedoch erheblich niedriger als das theoretische Maximum, da die Buttersäureproduktion von der Essigsäureerzeugung begleitet wird. Die Produktion von fermentativer Buttersäure wird hauptsächlich in synthetischen Wachstumsmedien mit Glucose, Xylose oder Saccharose als Kohlenstoffquelle durchgeführt. Während des letzten Jahrzehnts und als das Konzept der nachhaltigen Produktion von Brennstoffen und Chemikalien aus Restrohstoffen im Vordergrund stand, wurde Buttersäure aus Maisfasern hergestellt. Die Nutzung von Lignocellulose für die biologische Herstellung von Kraftstoffen und Chemikalien erfordert eine Vorbehandlung und enzymatische Hydrolyse, um Glucose und Xylose aus der Lignocellulose-Matrix freizusetzen. Vorbehandlungsverfahren setzen je nach Rohstoff und Härte der Vorbehandlung auch toxische Verbindungen frei, wie Carbonsäuren, Furanderivate und phenolische Verbindungen, die den mikrobiellen Stoffwechsel und das Wachstum hemmen. Daher könnte die Hemmung eines der ersten Hindernisse sein, die überwunden werden müssen, wenn Hydrolysate aus Biomassen der zweiten Generation für biologische Produktionsprozesse verwendet werden, insbesondere wenn unverdünnte Hydrolysate mit hohen Zuckerkonzentrationen verwendet werden.
Stoffwechsel im Darm
Im menschlichen Dickdarm entsteht Buttersäure vor allem beim Abbau von präbiotischen Kohlenhydraten durch Darmbakterien. Durch die damit verbundene pH-Wert-Verschiebung in den sauren Bereich wird das Milieu für Salmonellen und andere Krankheitserreger ungünstig. Buttersäure scheint darüber hinaus direkt die Darmbewegungen anzuregen und dient den Epithelzellen des Dickdarms als Energiequelle.
Geruch
Der Geruch von Buttersäure kann von Menschen und Tieren in kleinen Spuren wahrgenommen werden. Für den Menschen sind bereits Konzentrationen ab 0,06 mg pro Kubikmeter wahrnehmbar. Der Mensch bewertet den Geruch negativ, die Stubenfliege dagegen positiv. Zecken dient der Geruch von Buttersäure zum Auffinden ihrer Wirte.
Buttersäure ist neben Propionsäure, Schwefelwasserstoff und flüchtigen schwefelhaltigen organischen Verbindungen (Methanthiol, Dimethylsulfid) ein Verursacher von Mundgeruch beim Menschen.
Da die Entstehung von Buttersäure ein Zeichen von Fäulnis darstellt, dient ihre Geruchswahrnehmung als Warngeruch. Der Geruch von Buttersäure kann mit Basen, wie Natronlauge, Lösungen von Carbonaten usw. vermindert werden. Dabei bilden sich geruchlose Butyrate.
Verwendung
Zur Herstellung von preisgünstigen, besonders wirksamen und lange anhaltenden Stinkbomben wird nebst Schwefelwasserstoff Buttersäure verwendet. Der penetrante Geruchsstoff wird unter anderem auch dazu verwendet, Tiere mit feinem Geruchssinn zu vertreiben, beispielsweise Maulwürfe.
Buttersäure findet in verschiedenen Branchen Verwendung. Gegenwärtig besteht ein großes Interesse daran, sie als Vorstufe für Biokraftstoffe, z. B. Biobutanol, zu verwenden. Aufgrund des Anstiegs des Ölpreises sowie der kontinuierlichen Verringerung der Erdölverfügbarkeit und des wachsenden Bedarfs an sauberen Energiequellen wurden in jüngster Zeit Forschungsarbeiten auf alternative Kraftstoffquellen ausgerichtet.
Buttersäure findet auch zahlreiche Anwendungen in der pharmazeutischen und chemischen Industrie. Erstens ist Buttersäure für ihre Antikrebswirkung bekannt, da sie in einer Vielzahl von Zellen eine morphologische und biochemische Differenzierung induziert, die zur gleichzeitigen Unterdrückung der neoplastischen Eigenschaften führt. Infolgedessen wurden diese Studien an verschiedenen Prodrugs, die Derivate der Buttersäure sind, auf ihre mögliche Verwendung bei der Behandlung von Krebs und Hämoglobinopathien, einschließlich Leukämie und Sichelzellenanämie, sowie zum Schutz der Haarfollikel vor durch Strahlen- und Chemotherapie-induzierten Erkrankungen untersucht.
In der chemischen Industrie wird Buttersäure hauptsächlich zur Herstellung von Celluloseacetatbutyrat-Kunststoffen verwendet. Buttersäureester werden als Aromastoffe und Riechstoffe in der Getränke-, Lebensmittel- und Kosmetikindustrie verwendet.
Salze
Butyrate (systematisch auch Butanoate) ist neben einer Bezeichnung für Buttersäureester auch die Bezeichnung für die Salze der Buttersäure. Diese bestehen aus Butyrat-Anionen C3H7COO− und einem Kation. Beispiele sind Natriumbutyrat (NaC3H7COO), Magnesiumbutyrat [Mg(C3H7COO)2] und Ammoniumbutyrat (NH4C3H7COO). Bei Feuchtigkeit besitzen sie den gleichen charakteristischen Geruch wie Buttersäure. Wird ein Butyrat-Salz mit einer stärkeren Säure behandelt, entsteht wiederum Buttersäure.
Ester
Die Ester der Buttersäure haben in vielen Fällen einen Geruch nach Früchten und kommen in vielen Fruchtaromen natürlich vor.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 11.04. 2025

