Stickstoffdioxid
| Sicherheitshinweise | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||
| MAK |
| ||||||||||
Stickstoffdioxid, NO2, ist ein rotbraunes, giftiges, stechend chlorähnlich riechendes Gas. Das Gas gehört zur Gruppe der Stickoxide und kann leicht durch Druckerhöhung oder Abkühlung unter Dimerisierung zu N2O4 (Distickstofftetraoxid) verflüssigt werden. Stickstoffdioxid wird seit 1908 großtechnisch erzeugt und für die Herstellung von Salpetersäure verwendet. In Spuren entsteht Stickstoffdioxid aus Sauerstoff und Stickstoff als den beiden Hauptbestandteilen der Atmosphäre sowohl bei natürlichen Vorgängen wie z.B. durch Blitzschlag als auch bei technischen Verbrennungsvorgängen, z.B. in Verbrennungsmotoren.
| Strukturformel | ||
|---|---|---|
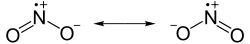 | ||
| Allgemeines | ||
| Name | Stickstoffdioxid | |
| Andere Namen |
| |
| Summenformel | NO2 | |
| Kurzbeschreibung | rotbraunes, stechend riechendes Gas | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 10102-44-0 | |
| EG-Nummer | 233-272-6 | |
| ECHA-InfoCard | 100.030.234 | |
| PubChem | 3032552 | |
| ChemSpider | 2297499 | |
| Eigenschaften | ||
| Molare Masse | 46,01 g/mol | |
| Aggregatzustand | gasförmig | |
| Dichte |
| |
| Schmelzpunkt | −11,2 °C | |
| Siedepunkt | 21,2 °C | |
| Dampfdruck | 963 hPa (20 °C) | |
| Löslichkeit | Hydrolyse in Wasser | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | 33,2 kJ/mol | |
Herstellung
Im Labor kann NO2 durch Erhitzen von Schwermetallnitraten (zum Beispiel Bleinitrat) hergestellt werden.
Technisch entsteht Stickstoffdioxid als Zwischenprodukt bei der Synthese von Salpetersäure durch Luftoxidation von Stickstoffmonoxid (NO). Außerdem entsteht Stickstoffdioxid bei der Reaktion von Salpetersäure mit Kupfer, da diese Reaktion mit dem Halbedelmetall nicht unter Bildung von Wasserstoff durch Reduktion der Säureprotonen abläuft, sondern unter Bildung von Stickstoffdioxid durch Reduktion der Nitrat-Anionen der Salpetersäure.
- Entstehung durch natürliche und industrielle Prozesse
Stickstoffdioxid ist seit 1908 ein Zwischenprodukt bei der technischen Herstellung von Salpetersäure nach dem von Wilhelm Ostwald entwickelten, großtechnischen Ostwald-Verfahren. Bei diesem Verfahren wird Ammoniak mit Luftsauerstoff bei 600–700 °C katalytisch zu Stickstoffmonoxid oxidiert, das in einem weiteren Schritt bei deutlich niedriger Temperatur weiter zu Stickstoffdioxid oxidiert wird. Das gebildete Stickstoffdioxid wird unter Luftoxidation mit Wasser zu Salpetersäure umgesetzt. Bei dem Verfahren gelangen Reste von Stickstoffdioxid NO2 und Stickstoffmonoxid NO als sog. Nitrose Gase über die Fabrikschornsteine in die Luft. Wegen der rötlichen Färbung des Gases wurden diese Abgase früher als die „roten Fahnen auf den Schornsteinen im Ruhrgebiet“ bezeichnet. In Freiheit gesetzt sammelt sich Stickstoffdioxid mit den höchsten Werten in Bodennähe an.
NO2 entsteht als Nebenprodukt bei jeder Verbrennung fossiler Energieträger, wie Gas, Kohle und Öl, und ist daher auch Bestandteil der Abgase von Kraft- und Luftfahrzeugen, von Öl- und Gas-Heizkesseln sowie von Gas- und Kohlekraftwerken. Es entsteht aus Stickstoffmonoxid, wobei die Konzentration von Stickstoffdioxid mit steigender Temperatur abnimmt. Bei Temperaturen von 700 bis 1700 °C liegen bei der Reaktion von Stickstoffmonoxid mit Sauerstoff nur 0,15 bis 1,8 ppm als Stickstoffdioxid vor. Erst unterhalb von 600 °C bildet sich Stickstoffdioxid in nennenswertem Umfang. Bei Verbrennungsmotoren liegt die maximale Stickstoffdioxidbildung im Temperaturbereich von 200 bis 300 °C.
In geringerem Umfang entsteht Stickstoffdioxid bei der Papierproduktion. Zudem entsteht es bei Lichtbögen an Luft, z.B. an Jakobsleitern.
Gewitter sind eine natürliche Quelle von atmosphärischem Stickstoffdioxid. Es entsteht auch durch mikrobiologische Umsetzungen im Boden. In Innenräumen werden Stickoxide vor allem durch offene Feuerstellen (z. B. Gasherde, Durchlauferhitzer, Petroleumlampen oder Kerzen) und das Tabakrauchen (100 bis 600 µg NOx pro Zigarette) verursacht. Wenn sich im Innenraum keine Quellen für Stickstoffdioxid befinden, wird die Außenluft zur Haupteintragsquelle für NO2 in den Innenraum. Dabei bleibt aber die Innenraumkonzentration deutlich unter der Konzentration von NO2 in der Außenluft.
Eigenschaften


Stickstoffdioxid ist ein braunrotes, charakteristisch riechendes, äußerst korrosives und stark giftiges Gas, das sich leicht verflüssigen lässt. Die Flüssigkeit ist kurz unterhalb des Siedepunktes (21,15 °C) rotbraun, wird beim Abkühlen immer heller bis blassgelb und erstarrt bei −11,20 °C zu farblosen Kristallen.
Bei 150 °C beginnt der Zerfall von NO2 in O2 und NO, bei 650 °C ist der Zerfall vollständig.
Stickstoffdioxid hat einen stechenden, hustenreizenden Geruch. Es ist relativ gut löslich in Wasser, wobei unter Disproportionierung Salpetersäure und Stickstoffmonoxid gebildet wird.
Das paramagnetische NO2 steht mit dem diamagnetischen farblosen Distickstofftetroxid N2O4 im Gleichgewicht, wobei sich dieses Gleichgewicht mit zunehmender Temperatur nach links verschiebt und unter 0 °C fast vollständig zu farblosem Distickstofftetroxid dimerisiert. Es sind (jeweils bei 1 bar Gesamtdruck) am Siedepunkt etwa 20 %, bei 50 °C 40 %, bei 100 °C 90 % und bei 140 °C fast 100 % des gasförmigen Distickstofftetroxid in Stickstoffdioxid gespalten. Flüssiges Distickstofftetroxid liegt am Siedepunkt noch zu 99,9 %, festes am Schmelzpunkt zu 99,99 % undissoziiert vor.
Durch dieses Gleichgewicht ändert sich auch die Dichte. Diese beträgt bei 0 °C für das ideale reine Gas NO2 2,05 g/l und für das ideale Gas N2O4 4,1 g/l. Der reale Wert von 3,6 g/l gilt somit für ein Gleichgewichtsgemisch der beiden Gase. Der kritische Punkt liegt bei 157,8 °C, 101,32 bar und 0,557 kg/l; der Tripelpunkt bei −11,20 °C und 0,1864 bar.
Stickstoffdioxid ist ein kräftiges Oxidationsmittel, das die Verbrennung (z.B. von Kalium, Phosphor, Kohle, Schwefel, Wasserstoff) lebhaft unterhält und mit organischen Verbindungen explosionsartig reagieren kann. Seine Oxidationskraft entspricht etwa der des Broms. Gegenüber starken Oxidationsmitteln, wie zum Beispiel Ozon, kann es auch als Reduktionsmittel wirken.
N2O4 und NO2 verhalten sich wie das gemischte Anhydrid der Salpetersäure und der Salpetrigen Säure. Mit Alkalihydroxidlösungen bilden sie Nitrate und Nitrite, z.B.:
Bei der Einleitung von NO2 in Wasser erfolgt Disproportionierung zu Salpetersäure und Salpetriger Säure, wobei letztere in der sauren Lösung zu NO2, NO und Wasser zerfällt.
In Anwesenheit von Luft wird NO zu NO2 oxidiert, so dass letztlich das gesamte eingeleitete NO2 in Salpetersäure überführt wird:
Stickstoffdioxid begünstigt erhöhte Ozonwerte in Bodennähe. Es zerfällt durch UV-A-Strahlung in Bodennähe (320–380 nm) in Stickstoffmonoxid und atomaren Sauerstoff, welcher mit dem Sauerstoff in der Luft zu Ozon reagieren. Da Ozon wiederum mit Stickstoffmonoxid zu Stickstoffdioxid reagiert bildet sich ein Gleichgewicht.
Stickstoffdioxid nimmt Einfluss auf die Atmosphärenchemie und den Ozongehalt in der Troposphäre.
Saurer Regen entsteht durch die Bildung von Salpetersäure (HNO3) in der Erdatmosphäre durch Reaktion von (2 NO2 + H2O → HNO3 + HNO2) oder durch Aufnahme von N2O5 in Aerosolpartikeln und nachfolgender Bildung von NO3− in der flüssigen Phase.
Verwendung
Stickstoffdioxid wird zur Herstellung von Salpetersäure verwendet, wozu es in Wasser eingeleitet wird und mit diesem reagiert. Sein Dimer Distickstofftetroxid wird in der Raketentechnik als Oxidationsmittel verwendet. Es dient weiterhin als nichtwässriges Lösungsmittel und wird zur Herstellung von Additionsverbindungen mit Metallen (z.B. Kupfer, Nickel) und Ammoniumnitrat (im Gemisch mit NO) verwendet.
Sicherheitshinweise
Stickstoffdioxid ist sehr giftig. Eingeatmetes Stickstoffdioxid löst in höheren Konzentrationen Kopfschmerzen und Schwindel aus. Es wirkt sich negativ auf Atemwegserkrankungen aus und kann zu Atemnot und Lungenödem führen. Grundsätzlich wird die Geruchswahrnehmung des Menschen gegenüber Stickstoffdioxid als sicheres Warnzeichen angesehen. Nitrose Gase haben einen charakteristischen stechenden Geruch und können mit Verzögerung von mehr als 24 Stunden (Latenzzeit) nach dem Einatmen noch zu einem Lungenödem führen. Es gibt Hinweise für eine Verminderung der Zeugungsfähigkeit als Spätfolge.
Stickstoffdioxid übt in höheren Konzentrationen (> 10 ppm = 20.000 µg/m³) eine Reizwirkung auf die Augenschleimhäute aus. Die Ausprägung der klinischen Effekte hängt weniger von der Expositionsdauer als von der Konzentration ab. Folgende Dosis-Wirkungs-Beziehungen wurden für eine 60 min-Exposition des Menschen dargestellt: 100 ppm (200.000 µg/m³) – Lungenödem mit Todesfolge, 50 ppm (100.000 µg/m³) – Lungenödem mit möglicher Folge einer subakuten oder chronischen Lungenschädigung, 25 ppm (50.000 µg/m³) – Atemtraktirritation und Brustschmerz. In einer neuen Studie an Freiwilligen wurde nachgewiesen, dass bereits kurzzeitige Expositionen (3 Stunden) gegenüber 1,5 ppm Stickstoffdioxid die Atemwegsreaktivität bei gesunden Personen steigern können. Nach längerfristiger Exposition gegenüber 1 ppm Stickstoffdioxid wurden Störungen der Lungenfunktion (erhöhter Atemwegswiderstand, verminderte Lungendehnbarkeit und reduzierte Vitalkapazität) beobachtet. Asthma-Patienten und Menschen mit chronischer Bronchitis scheinen nicht empfindlicher zu reagieren als Gesunde. Von besonderem Interesse sind auch die Stickstoffdioxid-Wirkungen auf den systemischen Immunstatus (Veränderungen der Antikörperproduktion, der Milzhistologie und der Zusammensetzung der Lymphozytensubpopulationen). Daraus wurde eine möglicherweise erhöhte Disposition von Menschen mit einer vorhandenen Immunsuppression gegenüber Stickstoffdioxid abgeleitet.
Grenzwerte
Arbeitsplatz und Innenräume
Der Grenzwert für Stickstoffdioxid von 950 µg/m³ gilt für bestimmte Industrie- und Handwerksarbeitsplätze und bezieht sich auf den Mittelwert einer Schicht, die in der Regel acht Stunden lang ist; er darf kurzzeitig und bis zu viermal pro Schicht um das Zweifache (als Mittelwert über 15 Minuten, Überschreitungsfaktor 2) überschritten werden. Der Arbeitsplatzgrenzwert gilt im Sinne der Gefahrstoffverordnung für Beschäftigte, bei denen aufgrund der Tätigkeiten am Arbeitsplatz eine erhöhte Stickstoffdioxid-Belastung zu erwarten ist. Dieser Wert wird als Arbeitsplatz-Richtgrenzwert auch in der Richtlinie (EU) 2017/164 aufgeführt. Der Wert gilt für gesunde Arbeitende an acht Stunden täglich und für maximal 40 Stunden in der Woche. Die Arbeitnehmerinnen und Arbeitnehmer, die berufsbedingt Schadstoffen ausgesetzt sind, erhalten zusätzlich eine arbeitsmedizinische Betreuung und befinden sich somit unter einer strengeren Beobachtung als die Allgemeinbevölkerung. Falschmeldungen, dass der Grenzwert von 950 µg/m³ für Büros gelte, führten zu Kritik am Grenzwert von 40 µg/m³ für den Jahresmittelwert im Freien.
Der Vorsorgegrenzwert von 80 µg/m³ als 60-Minuten-Mittelwert und der Gefahrengrenzwert von 250 µg/m³ als 60-Minuten-Mittelwert gilt für alle anderen Innenräume, in denen keine entsprechenden Tätigkeiten durchgeführt werden, z.B. Büros und Schulen, sowie für Wohnräume. Diese Werte hat der Ausschuss für Innenraumrichtwerte (AIR, ehemals Ad-hoc-Arbeitsgruppe der Kommission Innenraumlufthygiene) des Umweltbundesamtes 2018 festgelegt. Der Gefahrenrichtwert, auch Kurzzeitrichtwert II genannt, stellt einen wirkungsbezogen Wert dar, bei dessen Erreichen bzw. Überschreiten unverzüglich zu handeln ist, da bei einer dauernden Überschreitung dieses Richtwertes insbesondere bei empfindlichen Personen eine gesundheitliche Gefährdung gegeben sein kann.
Den Grenzwert von 40 µg/m³ für den Jahresmittelwert, der für die Außenluft gilt, sehen der AIR und die Arbeitsstättenverordnung auch für die Bewertung der langfristigen Belastung in Innenräumen vor.
Außenluft
EU-weit ist für Stickstoffdioxid in der Außenluft ein 1-Stunden-Grenzwert von 200 µg/m³ festgelegt worden, der nicht öfter als 18-mal im Kalenderjahr überschritten werden darf. Durch die EU-Richtlinie 2008/50/EG – (in deutschem Recht mit der 39. BImSchV umgesetzt: die Verordnung über Luftqualitätsstandards und Emissionshöchstmengen) ist ein Jahresgrenzwert von 40 µg/m³ im Jahresmittel festgelegt. Bei Inkrafttreten des Grenzwerts (in deutschem Recht mit der Verordnung über Immissionswerte für Schadstoffe in der Luft umgesetzt) im Jahr 2002 galt für diesen Jahresgrenzwert noch eine Toleranzmarge von 16 µg/m³. Sie verminderte sich ab 1. Januar 2003 bis zum 1. Januar 2010 stufenweise um jährlich 2 µg/m³. Seit 2010 ist die Toleranzmarge entfallen und der Jahresgrenzwert von 40 µg/m³ ist verbindlich einzuhalten.
In den USA gilt nach der Vorgabe der für die nationalen Umweltstandards zuständigen Gesundheitsbehörde EPA seit 2010 ein zu den EU-Kriterien annähernd vergleichbarer 1-Stunden-Grenzwert (100 ppb bzw. 191 µg/m³), aber ein gut doppelt so hoher Grenzwert für das Jahresmittel wie in der EU (53 ppb bzw. 100 µg/m³). In Kalifornien und sechzehn weiteren US-Bundesstaaten hingegen beträgt der Grenzwert für das Jahresmittel nur 30 ppb bzw. 57 µg/m³.
Für Stickstoffdioxid ist in der EU eine Alarmschwelle von 400 μg/m³ festgelegt. Wird dieser Wert in drei aufeinander folgenden Stunden an Orten gemessen, die für die Luftqualität in Bereichen von mindestens 100 km² oder im gesamten Gebiet/Ballungsraum repräsentativ sind, muss der betroffene Mitgliedsstaat umgehend geeignete Maßnahmen ergreifen.
2021 hat die Weltgesundheitsorganisation ihre Luftgüte-Richtlinie nach unten hin angepasst. Die neue Empfehlung bei Stickstoffdioxid liegt bei 10 µg/m³ im Jahresmittel und bei 25 µg/m³ im 24-Stunden-Mittel.
Luftbelastung
Zwischen 1990 und 2015 verringerte sich der Ausstoß an Stickstoffoxiden in Deutschland um 59 %. Trotz dieses deutlichen Rückgangs bei den Emissionen, also dem, was Kraftwerke, Heizungen oder Autos ausstoßen, führte dies nicht zu einer vergleichbaren Verringerung der Stickstoffdioxid-Konzentration, also dem, was bei Mensch und Umwelt ankommt. Im Jahr 2016 wurde der EU-Grenzwert von maximal 40 µg/m³ im Jahresmittel an 57 % der verkehrsnahen Messstationen überschritten. Der Straßenverkehr ist im urbanen Raum die Hauptquelle für Stickstoffoxide, da die höchsten Konzentrationen ausschließlich an viel befahrenen Straßen gemessen werden. Die Stickstoffdioxid-Jahresmittelwerte an verkehrsnahen Messstationen betragen mit leicht abnehmender Tendenz seit 1995 zwischen 30 und 60 µg/m³, vereinzelt sogar um 90 µg/m³. Von dem kraftfahrzeugverkehrsbedingten Anteil der Stickstoffoxidemissionen tragen in der Stadt etwa zu 60 % Diesel-Fahrzeuge bei. Der Grund ist zum einen, dass Dieselautos im Extremfall bis zu zehnmal so viele Stickstoffdioxid ausstoßen wie vergleichbare Benziner, zum anderen nutzen die sehr verbrauchsintensiven Fahrzeugklassen Bus und LKW hauptsächlich Diesel. In städtischen oder vorstädtischen Gebieten liegen die Jahresmittelwerte für Stickstoffdioxid im Bereich von etwa 20 bis 30 µg/m³, in ländlichen Gebieten um 10 µg/m³.
EU-Vertragsverletzungsverfahren
Am 17. Mai 2018 verklagte die Europäische Kommission Deutschland, Frankreich und das Vereinigte Königreich vor dem Gerichtshof der Europäischen Union (EuGH), weil die Grenzwerte für Stickstoffdioxid in diesen Ländern nicht eingehalten würden. Auch hätten diese Mitgliedstaaten keine geeigneten Maßnahmen ergriffen, um die Zeiträume, in denen die Grenzwerte überschritten werden, so kurz wie möglich zu halten. Die Mitgliedstaaten hätten „keine überzeugenden, wirksamen und zeitgerechten Maßnahmen vorgeschlagen, um die Verschmutzung schnellstmöglich – wie es das EU-Recht vorschreibt – unter die vereinbarten Grenzwerte zu senken.“ In Deutschland wurden die Grenzwerte in 26 Gebieten nicht eingehalten. Besonders betroffen waren die Großstädte Berlin, München, Hamburg, Köln, Stuttgart und Düsseldorf. Die im Jahr 2016 gemeldeten Jahreskonzentrationen beliefen sich z.B. in Stuttgart auf bis zu 82 µg/m³ bei einem Grenzwert von 40 µg/m³. Frankreich wurde im Oktober 2019 und Deutschland im Juni 2021 verurteilt.
Gesundheitliche Auswirkungen
Die Stickstoffdioxid-Exposition stellt gemäß Weltgesundheitsorganisation ein erhebliches Gesundheitsrisiko dar. In der wissenschaftlichen Literatur wird es durchweg mit nachteiligen Auswirkungen auf die Gesundheit in Verbindung gebracht.
In einer epidemiologischen Studie im Auftrag des Umweltbundesamtes wurden für das Jahr 2014 rund 6.000 vorzeitige Todesfälle aufgrund von Herz-Kreislauf-Erkrankungen statistisch ermittelt, die mit NO2 in Verbindung gebracht wurden. Dies entspricht einem Anteil von ungefähr 1,8 Prozent aller kardiovaskulären Todesfälle in Deutschland. Die Studie begründet so außerdem acht Prozent der bestehenden Diabetes-mellitus-Erkrankungen in Deutschland im Jahr 2014. Dies entspricht etwa 437.000 Krankheitsfällen. Bei bestehenden Asthmaerkrankungen liegt der prozentuale Anteil der Erkrankungen, die auf die Belastung zurückzuführen sind, bei rund 14 Prozent. Dies entspricht etwa 439.000 Krankheitsfällen. Der kausale Zusammenhang zwischen NO2-Belastung und niedriger Lebenserwartung ist aufgrund des oft gemeinsamen Auftretens anderer Giftstoffe mit Stickstoffdioxid (Feinstaub, Ozon und andere) von der WHO hinterfragt worden.
Anfang 2019 kam es in Deutschland zu einer vermeintlich wissenschaftlichen Debatte über die Gesundheitsgefahren von Luftverschmutzung und Stickoxiden. Ausgelöst wurde die Debatte von einer kleinen Gruppe von Lungenärzten und Ingenieuren um den Mediziner Dieter Köhler, die die wissenschaftliche Beleglage für Schadstoffgrenzwerte bezweifelte und die Aufweichung von Grenzwerten forderte. Obwohl die wissenschaftliche Beleglage zur Schädlichkeit der Luftverschmutzung zuvor stark angewachsen war und negative Gesundheitseffekte nachweislich auch deutlich unter den Grenzwerten auftreten, wurden die Behauptungen dieser Gruppe über reguläre Medien und soziale Medien rasch weit verbreitet und von Politikern, Industrieverbänden und Teilen der Öffentlichkeit begrüßt. Über zahlreiche Kommunikationswege, unter anderem Interviews und Talkshows, wurden dabei der Öffentlichkeit verzerrte und manipulative Behauptungen über den Forschungsstand präsentiert, um unsubstantiierte Falschbehauptungen in die Welt zu setzen und die Erkenntnisse wissenschaftlicher Studien in Frage zu stellen. Die verzerrte und massive Berichterstattung in Medien, wo die Debatte scheinbar ausgewogen als vermeintlich wissenschaftliche Diskussion mit zwei (gleichwertigen) Seiten präsentiert wurde, führte schließlich dazu, dass in der Bevölkerung große Zweifel am wissenschaftlichen Sachstand gesät wurden. Tatsächlich wies die vermeintlich wissenschaftliche Debatte jedoch alle Merkmale von anderen Falschinformationskampagnen auf, wie denjenigen zum Abstreiten der globalen Erwärmung oder den Kampagnen der Tabakindustrie zum Verteidigen ihrer Produkte.
Die Frage nach der Wirkung von Stickstoffdioxid auf die Gesundheit ist indes oft nur politisch motiviert, jedoch unter den meisten Wissenschaftlern unbestritten – entspricht also dem Stand der Wissenschaft. Der Klimareporter schreibt dazu, eine falsche Ausgewogenheit in den Medien würde das Thema zur Glaubensfrage machen.
Wirkung auf Pflanzen
Es gibt zahlreiche Pflanzen, die gegenüber Stickstoffdioxid empfindlich reagieren – empfindlicher als der Mensch. Bereits geringe Volumenanteile können normale biochemische Vorgänge beeinflussen und beispielsweise zu einer Minderung des Trockengewichts, des Blattwachstums und zu Ertragsverlust der Pflanzen führen. Zu diesen gehören z.B. Apfel- und Birnbaum, Weißbirke, Gerste, Salat. Bei diesen Pflanzen reicht ein Volumenanteil von 3 ppb aus, um bei einmaliger Einwirkung nach weniger als einer Stunde erste äußerliche Veränderungen auftreten zu lassen. (ppb, steht für „Teile pro Milliarde“ d.h. für die Zahl 10−9 ein Milliardstel.
Messtechnischer Nachweis von Stickstoffdioxid
Emissionsmessung
Bei Emissionsmessungen wird Stickstoffdioxid häufig zusammen mit Stickstoffmonoxid als Summenparameter messtechnisch erfasst. Beim Chemilumineszenz-Verfahren wird aus dem Abgas ein repräsentativer Teilstrom entnommen und nach Durchströmen eines Konverters, der möglicherweise vorhandenes Stickstoffdioxid in Stickstoffmonoxid umwandelt, mit Ozon in Verbindung gebracht. Das bei der Reaktion ausgesendete Licht wird von einem Photomultiplier in ein elektrisches Signal umgewandelt, das Aufschluss über die Stickstoffoxid-Konzentration gibt.
Beim Ionenchromatographie-Verfahren wird ein definiertes Abgasvolumen mit Ozon oder Wasserstoffperoxid in wässriger Lösung in Salpetersäure umgewandelt. Die analytische Bestimmung der Nitratkonzentration erfolgt ionenchromatographisch.
Immissionsmessung
Bei der Immissionsmessung von Stickstoffdioxid kann das Saltzman-Verfahren angewendet werden, bei dem die Probenluft durch eine Reaktionslösung geleitet wird, die mit der zu detektierenden Gaskomponente zu einem roten Azofarbstoff reagiert. Die Farbintensität der Reaktionslösung wird photometrisch bestimmt und ist ein Maß für die Masse an Stickstoffdioxid. Dieses Verfahren findet auch bei der Bestimmung von Stickstoffdioxid in der Innenraumluft Anwendung.
Ebenso wie bei der Emissionsmessung können auch bei der Immissionsmessung Chemilumineszenz-Verfahren zum Einsatz kommen. Das entsprechende Verfahren ist in der Norm EN 14211 beschrieben.
Eine weitere Möglichkeit der Immissionsmessung von Stickstoffdioxid ist die Verwendung von Passivsammlern. In einem nach unten geöffneten Glasröhrchen befindet sich ein mit Triethanolamin präpariertes Drahtnetz, auf dem Stickstoffdioxid abgeschieden wird. Das Drahtnetz wird nach Ende der Sammelzeit mit einer Kombinationsreagenz versetzt, um die entstehende Verfärbung photometrisch zu analysieren. Passivsammler können aufgrund ihrer Netzunabhängigkeit auch an abgelegenen Orten eingesetzt werden.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 24.05. 2025



