Antimon(III)-oxid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| MAK | Schweiz: 0,1 mg/m3 (gemessen als einatembarer Staub, gerechnet als Antimon)[6] | ||||||
Antimon(III)-oxid (auch Antimontrioxid genannt) ist eine Antimonverbindung mit der Summenformel Sb2O3. Es gehört zur Stoffklasse der Oxide.
| Strukturformel | ||
|---|---|---|
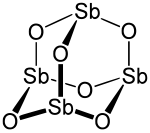
| ||
| Allgemeines | ||
| Name | Antimon(III)-oxid | |
| Andere Namen |
| |
| Summenformel | Sb2O3 | |
| Kurzbeschreibung | weißer, geruchloser Feststoff[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 215-175-0 | |
| ECHA-InfoCard | | |
| PubChem | | |
| Eigenschaften | ||
| Molare Masse | 291,50 g/mol | |
| Aggregatzustand | fest[1] | |
| Dichte | ||
| Schmelzpunkt | 655 °C[2] | |
| Siedepunkt | 1425 °C[2] | |
| Löslichkeit | praktisch unlöslich in Wasser (2,7 mg/l bei 20 °C)[4] | |
Vorkommen
Antimon(III)-oxid kommt in der Natur sowohl kubisch (Senarmontit) als auch rhombisch (Valentinit) kristallisiert vor.
Gewinnung und Darstellung
Antimontrioxid wird technisch durch Erhitzen von Antimontrisulfid (Grauspießglanz, Stibnit) an der Luft (Rösten) gewonnen oder durch Verbrennen von Antimon.
Bei der Hydrolyse von Antimon(III)-chlorid entsteht der bei Raumtemperatur metastabile Valentinit, der beim Behandeln mit Alkalien allmählich in Senarmontit übergeht.[3]
Eigenschaften
Physikalische Eigenschaften
Antimon(III)-oxid zeigt thermochrome Eigenschaften. Beim Erhitzen auf Temperaturen deutlich über 600 °C färbt sich die Verbindung gelb. Reversibel wird die Verbindung beim Abkühlen wieder weiß. Ursache der Farbänderung ist eine polymorphe, enantiotrope Umwandlung von der weißen kubischen Kristallform (Senarmontit) zu einer gelben orthorhombischen Kristallform (Valentinit) bei 606 °C. Die Bildungsenthalpie der kubischen Form beträgt ΔfH = −720,5 kJ·mol−1, die der orthorhombischen Form ΔfH = −708,5 kJ·mol−1, so dass sich für die polymorphe Umwandlung eine Umwandlungsenthalpie von ΔtH = 12 kJ·mol−1 ergibt.[8]
Chemische Eigenschaften

Antimontrioxid ist ein weißes kristallines Pulver, das in Wasser unlöslich ist, sich aber in konzentrierten Säuren und Laugen löst. Es entspricht in seiner Struktur dem Phosphortrioxid. Erhitzt man es auf über 800 °C, nimmt es weiteren Sauerstoff auf unter Bindung von Antimontetroxid Dieses stellt ein Mischoxid aus Antimontri- und Antimonpentaoxid dar. Wie die Löslichkeit in konzentrierten Säuren – wobei je nach Säurekonzentration neutrale Salze oder Oxidsalze entstehen – und in Laugen – wobei sich Antimonite bilden – zeigt, handelt es sich bei Antimontrioxid um ein amphoteres Oxid.
Verwendung
Antimontrioxid wird teils als Pigment und in der Emailleproduktion verwendet. In der Galvanik dient es zum Antimonieren anderer Metalle. Es wird auch als Katalysator für die Herstellung von Polyethylenterephthalat (PET) verwendet. Zusammen mit einer Dotierung aus Zinn wird es als Pigment für helle und transparente Antistatik-Beschichtungen verwendet und bei Flammschutzmitteln wie Decabromdiphenylether wird Antimontrioxid als Synergist eingesetzt.[9]
Sicherheitshinweise/Toxikologie
Antimontrioxid ist im Anhang der Verordnung (EG) Nr. 1272/2008 als Karzinogen, Kategorie 2, mit dem H-Satz H351 (kann vermutlich Krebs erzeugen) eingestuft. Die Internationale Agentur für Krebsforschung (IARC) betrachtet Antimontrioxid als „möglicherweise krebserzeugende Substanz“, Kategorie 2B.[10][11] Die Einstufung erfolgte auf Grundlage von drei chronischen Inhalationsstudien mit Ratten. Der wahrscheinlichste Mechanismus der Karzinogenität beruht auf einer eingeschränkten Lungenreinigung nach Überladung durch Partikel, der eine Entzündungsreaktion, Fibrose und Tumorbildung folgen. Daher kann Antimontrioxid als Karzinogen mit Schwellenwert betrachtet werden. In diesem Kontext ist es jedoch fraglich, ob Auswirkungen infolge einer Lungenüberladung bei der Ratte auch für den Menschen relevant sind (European Commission, European Union Risk Assessment Report Diantimony trioxide, 2008). Es besteht kein Verdacht für eine karzinogene Wirkung nach oraler Gabe.
Antimon(III)-oxid wurde 2016 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Antimon(III)-oxid waren die Besorgnisse bezüglich Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung sowie der vermuteten Gefahren durch krebserregende Eigenschaften. Die Neubewertung läuft seit 2018 und wird von Deutschland durchgeführt. Um zu einer abschließenden Bewertung gelangen zu können, wurden weitere Informationen nachgefordert.[12]
Einzelnachweise
- ↑ Hochspringen nach: a b Datenblatt
 Antimon(III)-oxid
bei Merck.
Antimon(III)-oxid
bei Merck.
- ↑ Hochspringen nach: a b c David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Properties of the Elements and Inorganic Compounds, S. 4-48.
- ↑ Hochspringen nach: a b Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band I, Ferdinand Enke, Stuttgart 1975, ISBN 3-432-02328-6, S. 593.
- ↑ Hochspringen nach: a b
c Eintrag zu
 Antimon(III)-oxid in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Antimon(III)-oxid in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Eintrag zu
 Diantimony trioxide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und
Kennzeichnung
Diantimony trioxide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und
Kennzeichnung  erweitern.
erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 1309-64-4 bzw. Antimon(III)-oxid).
Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 1309-64-4 bzw. Antimon(III)-oxid).
- ↑ A. F. Holleman, E. Wiberg: Lehrbuch der Anorganischen Chemie. 57.–70. Auflage. Walter de Gruyter, Berlin 1964, S. 287.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 91.–100., verbesserte und stark erweiterte Auflage. Walter de Gruyter, Berlin 1985, ISBN 3-11-007511-3, S. 687.
- ↑ Umweltbundesamt:
 Bromierte Flammschutzmittel in Elektro- und Elektronikgeräten:
Das Flammschutzmittel Decabromdiphenylether (DecaBDE) ist durch umweltverträglichere Alternativen ersetzbar
(im Internet Archive) (PDF-Datei; 54 kB), Februar 2007.
Bromierte Flammschutzmittel in Elektro- und Elektronikgeräten:
Das Flammschutzmittel Decabromdiphenylether (DecaBDE) ist durch umweltverträglichere Alternativen ersetzbar
(im Internet Archive) (PDF-Datei; 54 kB), Februar 2007.
- ↑
 List of Classifications – IARC Monographs on the Identification of Carcinogenic Hazards to Humans. In:
monographs.iarc.who.int. (englisch). (Suche nach: Antimon)
List of Classifications – IARC Monographs on the Identification of Carcinogenic Hazards to Humans. In:
monographs.iarc.who.int. (englisch). (Suche nach: Antimon)
- ↑ Bundesamt für Gesundheit Schweiz (BAG):
 Risikoanalyse: Antimon in Lebensmitteln und Fertiggerichten,
die direkt in PET-Schalen zubereitet werden. (PDF; 128 kB) 23. August 2007. (autom. Download)
Risikoanalyse: Antimon in Lebensmitteln und Fertiggerichten,
die direkt in PET-Schalen zubereitet werden. (PDF; 128 kB) 23. August 2007. (autom. Download)
- ↑ Community rolling action plan (CoRAP) der
Europäischen Chemikalienagentur (ECHA):
 Diantimony trioxide.
Diantimony trioxide.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 16.05. 2025
