
Gluconsäure
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
D-Gluconsäure ist eine Carbonsäure aus der Gruppe der Fruchtsäuren. In der Systematik der von Kohlenhydraten abgeleiteten Verbindungen ist sie der Gruppe der Onsäuren zugeordnet. Sie unterscheidet sich von der D-Glucose durch die Oxidationsstufe am ersten Kohlenstoff (C1), wo eine Carboxygruppe statt einer Aldehydgruppe vorliegt. Gluconat ist das Anion der Gluconsäure.
| Strukturformel | ||
|---|---|---|
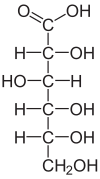
| ||
| Allgemeines | ||
| Name | D-Gluconsäure | |
| Andere Namen | ||
| Summenformel | C6H12O7 | |
| Kurzbeschreibung | sirupöse Flüssigkeit, in reinem Zustand kristallin | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 208-401-4 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 196,16 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,24 g/cm3 | |
| Schmelzpunkt | 131 °C | |
| Siedepunkt | 417 °C | |
| Löslichkeit | ||
Vorkommen

Gluconsäure kommt in geringen Mengen in zahlreichen Früchten und Wein vor und ist dort für einen leicht sauren, erfrischenden Geschmack verantwortlich. Auch Kombucha (ein Getränk aus fermentiertem Tee), Honig und Bionade enthalten Gluconsäure.
Entdeckung
Durch Behandeln von Stärke oder Dextrin mit Brom in wässriger Lösung wurden Säuren der Zusammensetzung C6H12O7 erhalten, die als Glykonsäure oder Dextronsäure bezeichnet wurden.
Nachdem die Konstitution gesichert war, wurde sie nach der Fischer-Nomenklatur D-Gluconsäure genannt. Heinrich Kiliani und S. Kleemann berichteten, dass eine wässrige Lösung von Traubenzucker d.h. D-Glucose nach Zugabe von Brom "fast quantitativ" in eine Carbonsäure umgewandelt, d.h. oxidiert wird.
Die Säure bildete u.a. ein relativ schwerlösliches Calciumsalz, welches zur Reinigung und Isolierung herangezogen wurde.
Gewinnung und Darstellung
Für die Oxidation wurden elektrochemische Verfahren entwickelt (anodische Oxidation). H. S. Isbell und H. C. Frush führten sie in Gegenwart von Calciumcarbonat und eines wasserlöslichen Bromids, z.B. Natriumbromid durch. Das schwerlösliche Calciumgluconat kristallisiert zum Teil schon während der Elektrolyse aus. Das Verfahren wurde in industriellen Maßstab ausgeführt.
Heute wird aber zur industriellen Gluconsäureherstellung ausschließlich der biochemische Weg der Fermentation beschritten.
Die Fermentation von Glucose zu Gluconsäure kann außer von Gluconobacter oxydans (die taxonomische Gruppe enthält auch Acetobacter suboxydans und Gluconobacter suboxydans) auch von Aspergillus niger, verschiedenen Acetobacter, Mischungen der vorangehenden Mikroorganismen oder durch Zugabe der Enzyme Glucose-Oxidase und Katalase bewirkt werden.
D-Gluconsäure wird auch durch milde Oxidation der D-Glucose mit Iod in alkalischer Lösung gebildet. Sie ist auch das Nebenprodukt in der quantitativen Bestimmung reduzierender Zucker (Methode nach Luff-Schoorl). Kupfer(II)-sulfat oxidiert dabei die D-Glucose zu D-Gluconsäure, wobei Kupfer(II) zu Kupfer(I) reduziert wird.
Chemische Eigenschaften
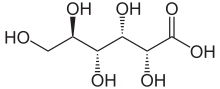
Im sauren Medium oder beim Versuch, die freie Säure aus Lösungen zu isolieren, bildet sich aus D-Gluconsäure sehr leicht unter Wasserabspaltung D-Gluconolacton (Gluconsäure-δ-lacton). D-Gluconsäure ist daher im Handel nur in Form wässriger Lösungen oder in Form ihrer Salze erhältlich.
Verwendung
Lebensmittel
Gluconsäure (E 574) und ihre Salze dienen in Lebensmitteln als künstlicher Säureregulator, als Stabilisator oder wie Calciumgluconat (E 578) bzw. Calciumlactatgluconat als Calciumquelle. Eisengluconat (E 579) dient zur intensiveren Schwarzfärbung von schwarzen Oliven. D-Gluconolacton wird als Lebensmittelzusatzstoff E 575 verwendet. In dem im Handel erhältlichen Erfrischungsgetränk „Bionade“ ist Gluconsäure als Produkt eines Fermentationsprozesses enthalten. In Backpulvern hat D-Gluconolacton den Vorteil, dass es erst durch die Wärmezufuhr mit Natriumhydrogencarbonat zu Natriumlactatgluconat und Kohlenstoffdioxid reagiert. Der Backtrieb erfolgt somit erst während des Backvorgangs und nicht bereits beim Kneten bzw. Rühren des Teigs. Hierbei ist D-Gluconsäure als Zwischenprodukt beteiligt. Übermäßiger Genuss von Gluconsäure oder gluconsäurehaltigen Produkten kann abführend wirken.
Technik
Gluconsäure wird als milde Säure in Metallbeizmitteln verwendet.
Medizin
Eisengluconat ist in einigen Medikamenten gegen Eisenmangel enthalten. Auch andere Metallgluconate sind in entsprechenden Präparaten enthalten, z.B. Zinkgluconat. Gluconat wird vom Körper gut aufgenommen (resorbiert). Dabei „schleppt“ das Anion das als Kation gebundene Spurenelement mit in den Körper und ermöglicht so dessen effiziente Aufnahme. Dieser Effekt zeigt sich auch auf der Haut: Nach Flusssäure-Verätzungen wird ein Calciumgluconatgel in die Haut einmassiert. Das Gluconat erleichtert die Aufnahme des Calciums, das im Körper das giftige lösliche Fluorid durch Bildung des unlöslichen Calciumfluorids unschädlich macht.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025