
tert-Butylbromid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
tert-Butylbromid ist eine organische Verbindung mit einem Bromatom als Substituenten und einem tertiären Kohlenstoffatom. Die Verbindung zählt als Alkylbromid zu den Halogenkohlenwasserstoffen und wird beispielsweise als Edukt zur Synthese verwendet. Isomere sind das 1-Brombutan, das 2-Brombutan und das 1-Brom-2-methylpropan, die zusammen die Gruppe der Butylbromide bilden.
| Strukturformel | ||
|---|---|---|
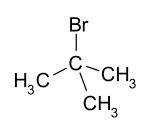
| ||
| Allgemeines | ||
| Name | tert-Butylbromid | |
| Andere Namen |
| |
| Summenformel | C4H9Br | |
| Kurzbeschreibung | farblose Flüssigkeit mit charakteristischem Geruch[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 208-065-9 | |
| ECHA-InfoCard | | |
| PubChem | | |
| Eigenschaften | ||
| Molare Masse | 137,02 g/mol | |
| Aggregatzustand | flüssig[1] | |
| Dichte | 1,2125 g/cm3[1] | |
| Schmelzpunkt | −16,2 °C[1] | |
| Siedepunkt | 73,3 °C[1] | |
| Dampfdruck | 179,9 mbar (25 °C)[1] | |
| Löslichkeit | praktisch unlöslich in Wasser (20 °C)[1] | |
| Brechungsindex | 1,4279 (20 °C, 589 nm)[2] | |
Gewinnung und Darstellung
Eine Möglichkeit zur Darstellung ist die Umsetzung von tert-Butanol mit Bromwasserstoff. Eine andere ist die Reaktion von Isobutan mit Brom.[3]
Eigenschaften
tert-Butylbromid ist eine sehr leicht flüchtige, farblose Flüssigkeit mit charakteristischem Geruch, die praktisch unlöslich in Wasser ist.[1] Es wird bei Mischen mit Wasser rasch zu tert-Butanol und Bromwasserstoff hydrolysiert.[3] Löst man es in Methanol, reagiert es rasch zu 2-Methoxy-2-methylpropan (durch Solvolyse) und 2-Methylpropen.[4] Das technische Produkt wird mit Kaliumcarbonat stabilisiert.[2]
Einzelnachweise
- ↑ Hochspringen nach: a b c d
e f g h i
j Eintrag zu
 2-Brom-2-methylpropan in der GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 08. November 2025. (JavaScript erforderlich)
2-Brom-2-methylpropan in der GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 08. November 2025. (JavaScript erforderlich)
- ↑ Hochspringen nach: a b Datenblatt
 2-Brom-2-methylpropan bei Merck, abgerufen am 08. November 2025.
2-Brom-2-methylpropan bei Merck, abgerufen am 08. November 2025.
- ↑ Hochspringen nach: a b Joachim Buddrus,
Bernd Schmidt: Grundlagen der Organischen Chemie. Walter de Gruyter, 2011, ISBN 3-11-024894-8, S. 260
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Uni-Tübingen:
 Halogenalkane
(im Internet Archive) (PDF-Datei; 464 kB).
Halogenalkane
(im Internet Archive) (PDF-Datei; 464 kB).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 08.11. 2025
