Diboran
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | Schweiz: 0,1 ml/m3 bzw. 0,1 mg/m3 | ||||||||
Diboran ist eine chemische Verbindung aus den Elementen Bor und Wasserstoff. Es besitzt die Summenformel B2H6 und ist die einfachste Verbindung aus der Stoffklasse der Bor-Wasserstoff-Verbindungen (Borane).
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Diboran |
| Andere Namen |
|
| Summenformel | B2H6 |
| Kurzbeschreibung | farbloses Gas mit abstoßend süßlichem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 19287-45-7 |
| EG-Nummer | 242-940-6 |
| ECHA-InfoCard | 100.039.021 |
| PubChem | 6328200 |
| ChemSpider | 17215804 |
| Eigenschaften | |
| Molare Masse | 27,67 g/mol |
| Aggregatzustand | gasförmig |
| Dichte | 1,17 kg/m3 (15 °C, 1 bar) |
| Schmelzpunkt | −164,85 °C |
| Siedepunkt | −92,5 °C |
| Dampfdruck | 2,8 MPa (0 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | 36,4 kJ/mol |
Geschichte
Diboran wurde zum ersten Mal im 19. Jahrhundert durch Hydrolyse von Metallboriden synthetisiert, aber nicht eingehend untersucht. Von 1912 bis 1936 erforschte der große Pionier der Chemie der Borhydride Alfred Stock diese Verbindungen, was zu Methoden für die Synthese und Handhabung der sehr reaktiven, flüchtigen und oft giftigen Borhydride führte. Er schlug zuerst eine dem Ethan ähnliche Struktur für Diboran vor. Die Beugung von Elektronenstrahlen nach Versuchen von S.H. Bauer unterstützte die von ihm vorgeschlagene Struktur.
In der Kommunikation von H. I. Schlesinger mit L. Pauling (der ebenfalls die Ethanstruktur annahm), wurde die Dreizentrenbindung in seiner klassischen Überprüfung in den frühen 1940er-Jahren aber nicht ausdrücklich diskutiert. Die Überprüfung diskutierte jedoch die C2v-Struktur tiefgreifend: „Es ist zu erkennen, dass diese Annahme leicht viele der chemischen Eigenschaften von Diboranen erklärt ...“.
Im Jahre 1943 veröffentlichte der Bachelor-Student am Balliol College in Oxford Christopher Longuet-Higgins zusammen mit R. P. Bell die heute akzeptierte Struktur von Diboran. Diese wurde allerdings schon im Jahre 1921 in der damaligen Sowjetunion beschrieben. In den Jahren nach dem Vorschlag von Longuet-Higgins/Bell gab es eine umfangreiche Diskussion über die richtige Struktur. Die Debatte endete 1951 mit den Elektronenbeugungs-Messungen von K. Hedberg und V. Schomaker, welche die bis heute anerkannte Struktur von Diboran bestätigten.
William Nunn Lipscomb Jr. bestätigte die molekulare Struktur der Borane durch Röntgenstrukturanalyse in den 1950er-Jahren und entwickelte Theorien zur Erklärung dieser Bindung. Später nutzte er die gleichen Methoden für ähnliche Probleme, einschließlich der Struktur von Carboranen. Lipscomb erhielt für seine Bemühungen 1976 den Nobelpreis für Chemie.
Vorkommen
Diboran kommt nicht natürlich vor.
Gewinnung und Darstellung
Zur Herstellung von Diboran gibt es mehrere Möglichkeiten:
Reaktion von Lithiumhydrid mit Bortrifluorid:
Reaktion von Lithiumtetrahydroaluminat mit Bortrichlorid in Diethylether:
Reaktion von Natriumboranat mit Bortrifluorid in Ethylenglycoldimethylether:
Reaktion von Natriumboranat mit Iod in Ethylenglycoldimethylether oder THF:
Reaktion von Kaliumborhydrid mit Phosphorsäure:
Technische Herstellung
Boran wird technisch durch Hydrierung von Dibortrioxid (B2O3) mithilfe von metallischem Aluminium und Aluminiumchlorid als Reduktionsmittel bei Temperaturen oberhalb 150 °C und bei einem Wasserstoffdruck von 750 bar hergestellt.
Eigenschaften
Diboran ist ein farbloses, brennbares, hochgiftiges Gas mit stechendem, süßlichem, widerlichem Geruch. Es ist eine bei Standardbedingungen metastabile Verbindung. Oberhalb von 50 °C beginnt seine Zersetzung zu Wasserstoff und höheren Boranen (Tetraboran, Pentaboran, Hexaboran, Decaboran und andere). Die Zündtemperatur des reinen Diborans liegt bei 145 °C. Enthält es Spuren höherer Borane, kann es sich an der Luft spontan selbstentzünden und verbrennt unter starker Wärmeentwicklung.
In der Praxis zündet es daher schon bei etwa 45 ;°C. Bei einem
Luftvolumenanteil von 0,8 bis 8 % bildet es explosive Gemische. Da das Gas
deshalb mit Vorsicht zu handhaben ist, lässt man es meist mit Aminen ()
zu Aminoboran-Komplexen
reagieren.
Diese (flüssigen) Substanzen dienen als Vorstufe für Diboran und können ohne Gefahr aufbewahrt und transportiert werden. Die Wiedergewinnung erfolgt durch Zugabe starker Säuren (z.B. Salzsäure).
Beim Lösen in Wasser reagiert Diboran mit diesem. Im Labormaßstab kann man Diboran durch Oxidation von Natriumborhydrid mit Iod in Diglyme darstellen.
Struktur
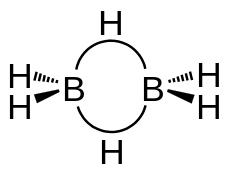
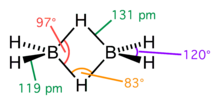
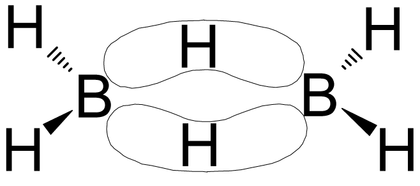
Diboran ist die einfachste Verbindung aus der Stoffklasse der Borane, da monomeres Boran (BH3) nicht stabil ist und das metastabile Addukt Diboran bildet. Die Borkerne sind hierbei tetraedrisch von vier Wasserstoffkernen umgeben. Die beiden verbrückenden Wasserstoffkerne bilden eine 2-Elektronen-3-Zentren-Bindung aus, um den Elektronenmangel der Borkerne zu kompensieren. Zwei Elektronen befinden sich hierbei in einem über drei Atome verteilten Orbital.
Chemische Eigenschaften
Das Bor im Diboran besitzt bedingt durch die Zwei-Elektronen-Dreizentrenbindungen zu den beiden Brücken-Wasserstoffatomen einen Elektronenmangel. Dadurch ist Diboran eine einwertige Lewis-Säure und reagiert unter Bildung von koordinativen Bindungen zu Lewis-Basen (wie Ammoniak) unter Spaltung in monomere Borane. Mit gasförmigem Ammoniak bildet sich entsprechend BH3·NH3.
Die Salze von Diboran enthalten das Monoboranat/Tetrahydroboranat/Tetrahydridoboranat Ion BH4− und werden Monoboranate/Tetrahydroboranate genannt. Ein wichtiger Vertreter ist das durch Umsetzung von Diboran mit Natriumhydrid entstehende Natriumboranat.
Verwendung
Diboran ist das wichtigste Reagenz für Hydroborierungen, wobei Alkene (R ein beliebiger Rest) über die B–H-Bindungen zu Trialkylboranen verbunden werden.
Diese Reaktion ist regioselektiv und die entstehenden Trialkylborane können leicht in andere nützliche organische Derivate umgewandelt werden.
Diboran wird auch als Reduktionsmittel etwa als Ergänzung zu der Reaktivität von Lithiumaluminiumhydrid verwendet. Die Verbindung reduziert leicht Carbonsäuren zu den entsprechenden Alkoholen. Es wurde auch als Raketentreibstoff in Erwägung gezogen, allerdings erwies es sich als völlig ungeeignet, da es bei der Verbrennung Bortrioxid bildet, das die Triebwerke verstopft. Diboran wird weiterhin für die Gummivulkanisierung verwendet. Borverbindungen werden allgemein als Katalysatoren bei der Polymerisation von Kohlenwasserstoffen oder bei der Herstellung von Anti-Markownikow-Produkten verwendet.
Sicherheitshinweise
Die Inhalation von Diboran führt zu Husten, Halsschmerzen, Schwindel, Atembeschwerden, Übelkeit und Mattigkeit. Es ist hochgiftig und hochentzündlich.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 11.05. 2024


