Bortrioxid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: fortpflanzungsgefährdend (CMR) | ||||||
| MAK | Schweiz: 10 mg·m−3 (gemessen als einatembarer Staub) | ||||||
| Toxikologische Daten | 3163 mg/kg (LD50, Maus, oral) | ||||||
Bortrioxid oder Dibortrioxid ist eine chemische Verbindung der Elemente Bor und Sauerstoff mit der Summenformel B2O3.
| Kristallstruktur | |
|---|---|
 | |
| __ B3+ __ O2− | |
| Allgemeines | |
| Name | Bortrioxid |
| Andere Namen |
|
| Verhältnisformel | B2O3 |
| Kurzbeschreibung | farblose, hygroskopische Masse |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 1303-86-2 |
| EG-Nummer | 215-125-8 |
| ECHA-InfoCard | 100.013.751 |
| PubChem | 518682 |
| ChemSpider | 452485 |
| Eigenschaften | |
| Molare Masse | 69,62 g/mol |
| Aggregatzustand | fest |
| Dichte |
2,56 g/cm3 (kristallin) 1,83 g/cm3 (amorph) |
| Schmelzpunkt | 475 °C (kristallin) |
| Siedepunkt | 2250 °C |
| Löslichkeit | wenig in Wasser (36 g/l bei 25 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −1273,5(14) kJ/mol |
Geschichte
Bortrioxid war Ausgangspunkt zur ersten Darstellung von Bor. Im Jahre 1808 gelang den französischen Chemikern Joseph Louis Gay-Lussac und Louis Jacques Thénard erstmals die Darstellung von unreinem Bor aus Bortrioxid durch Reduktion mit Kalium. Das erste hochreine Bor wurde dann im Jahre 1909 von dem amerikanischen Chemiker W. Weintraub durch die Reduktion von gasförmigem Bortrioxid mit Wasserstoff im Lichtbogen gewonnen.
Gewinnung und Darstellung
Glüht man Borsäure, so erhält man eine farblose, glasig-amorphe Masse (Boroxidglas), die schwierig zu kristallisieren ist:
Durch langsame Dehydratisierung von Borsäure bei 150–250 °C kann kristallines Bortrioxid hergestellt werden.
Im Jahr 2007 wurden weltweit etwa 3,8 Millionen Tonnen Bortrioxid produziert. Hauptproduzenten sind die Türkei, Argentinien und Chile.
Eigenschaften
Bortrioxid reagiert sauer und bildet Borsäure bei Kontakt mit Wasser. Sowohl die amorphe als auch die kristalline Form sind hygroskopisch. Bei Reduktion mit Magnesium, Kalium, Wasserstoff und anderen entsteht Bor.
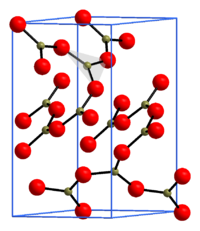
Bortrioxid (α-Bortrioxid) kristallisiert trigonal in
der Raumgruppe
P3121 (Raumgruppen-Nr. 152) bzw. P3221
(Nr. 154) mit den Gitterparametern
a = 434 pm und c = 834 pm sowie
sechs Formeleinheiten
pro Elementarzelle.
In der Kristallstruktur
ist jedes Boratom von je drei Sauerstoffatomen planar umgeben, die einzelnen
[BO3]3−-Einheiten sind über alle drei Sauerstoffatome
jeweils mit benachbarten Boratomen verbunden, wodurch sich ein dreidimensionales
Netzwerk ergibt. Dieses Netzwerk lässt sich mit der Niggli-Formel
beschreiben, wodurch sich ein Bor-Sauerstoff-Verhältnis von 1:1,5 bzw. 2:3
ergibt, was sich in der chemischen Formel B2O3
widerspiegelt. Bei der Verbindung B2O3 handelt es sich
korrekt betrachtet damit nicht um ein Trioxid, sondern um ein Sesquioxid.
Neben der α-Form und der amorphen Form existiert auch eine Hochtemperaturvariante (β-Bortrioxid).
Bortrioxid wird aufgrund seiner Reproduktionstoxizität seit Juni 2012 als „Substance of Very High Concern“ (deutsch: „Besonders besorgniserregende Stoffe“) eingestuft.
Verwendung
Bortrioxid ist ein Ausgangsstoff zur Herstellung weiterer Borverbindungen (z.B. reinem Bor, Borkarbid, Borsäuretrimethylester durch Auflösung in Methanol, Diboran durch Hydrierung). Praktische Verwendung findet es als Flussmittel bzw. Bestandteil (Borsilikatglas, Borphosphatglas) in Emails und Gläsern. In heißgepresster Bornitrid-Keramik vermag es in Mengen von 2–6 % als Bindemittel zu fungieren. Bortrioxid wird unter anderem auch als Feuerlöschmittel bei Bränden von Metall eingesetzt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.09. 2024
