Aluminiumchlorid
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| Toxikologische Daten | 3450 mg/kg (LD50, Ratte, oral) | |||||||
Aluminiumchlorid ist eine anorganische chemische Verbindung; es ist das Chlorid des Aluminiums mit der Summenformel AlCl3.
| Kristallstruktur | |
|---|---|
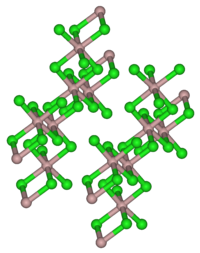 | |
| _ Al3+ _ Cl− | |
| Kristallsystem | monoklin |
| Raumgruppe | C2/m (Nr. 12) |
| Allgemeines | |
| Name | Aluminiumchlorid |
| Andere Namen |
|
| Verhältnisformel | AlCl3 |
| Kurzbeschreibung | weißer bis gelblicher Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| EG-Nummer | 231-208-1 |
| ECHA-InfoCard | 100.028.371 |
| PubChem | 24012 |
| DrugBank | DB11081 |
| Arzneistoffangaben | |
| Wirkstoffklasse | Adstringens |
| Eigenschaften | |
| Molare Masse | 133,34 g/mol |
| Aggregatzustand | fest |
| Dichte | 2,44 g/cm3 |
| Sublimationspunkt | 180 °C (262 °C Zersetzung) |
| Löslichkeit | gut in Wasser (450 g/l bei 20 °C, Zersetzung) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −704 kJ·mol−1 |
Synthese
Wasserhaltiges Aluminiumchlorid (in rhombischen Kristallen auftretendes Hexahydrat AlCl3 · 6 H2O) entsteht durch Auflösen von Aluminium in Salzsäure:
Dieses Hexahydrat kann jedoch nicht entwässert werden, da es sich beim Erhitzen zu Aluminiumhydroxid bzw. Aluminiummetahydroxid und Chlorwasserstoffgas zersetzt:
So muss die Herstellung von wasserfreiem Aluminiumchlorid durch Überleiten von Chlor über Kohlenstoff und Aluminiumoxid bei etwa 800 °C oder direkt aus den Elementen erfolgen:
beziehungsweise:
Für die großtechnische Herstellung von Aluminiumchlorid werden aufgrund der hohen Aggressivität der beteiligten Reaktanten emaillierte Rührbehälter verwendet.
Eigenschaften
Aluminiumchlorid bildet farblose, hexagonale Kristalle (monokline Kristallstruktur, Raumgruppe C2/m (Raumgruppen-Nr. 12), a = 5,914 Å, b = 10,234 Å, c = 6,148 Å, β = 108,25°). Es ist in vielen organischen Lösungsmitteln löslich. Das meist auf Grund von Verunreinigungen mit Eisenchloriden hellgelbe Pulver wirkt stark hygroskopisch. In feuchter Luft raucht es wegen teilweiser Hydrolyse zu Chlorwasserstoff und Aluminiumoxidchlorid. In Wasser löst es sich unter starker Erwärmung unter Bildung des Hexahydrats. In unpolaren Lösungsmitteln, flüssiger Phase sowie im Dampfzustand liegt Aluminiumchlorid als Dimer (Al2Cl6) vor, in dem das Aluminiumatom tetraedrisch koordiniert ist (analog zum Aluminiumbromid). Im festen Zustand liegt ein Ionengitter vor, in dem das Aluminiumion 6-fach durch Cl− koordiniert ist. Beim Schmelzen bricht das Ionengitter unter Bildung des Dimeren zusammen. Da dieses kovalent aufgebaut ist, leitet flüssiges Aluminiumchlorid den elektrischen Strom nur schlecht.
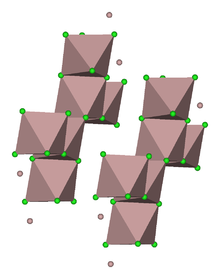
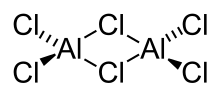
Die Bindungsverhältnisse in Aluminium(III)-chlorid sind als Grenzfall zwischen kovalenter und ionischer Bindung einzuordnen, es hat eine Elektronegativitäts-Differenz ΔEN von 1,55 (nach Pauling). Damit sollte es sich eigentlich um eine polare Atombindung handeln.
Reaktionsverhalten
In stark exothermer Reaktion kommt Aluminiumchlorid in Wasser in Lösung, wobei eine Hydrolyse in Chloridionen und Hexaaquaaluminiumkomplexe erfolgt:
Diese Hexaaquaaluminiumionen wirken als schwache Säure (pKs = 4,97):
Das Hydrat kann nicht durch Erhitzen zum wasserfreien Aluminiumchlorid entwässert werden, da unter Freisetzung von Wasser und Chlorwasserstoff das Aluminiumhydroxid bzw. das Aluminiumoxid entsteht.
Verwendung
Das Hexahydrat des Aluminiumchlorids findet auf Grund seiner stark adstringierenden Wirkung in der Textil- und Seifenindustrie Verwendung, wo es unter anderem der Herstellung von antiseptischen Mitteln oder Deodorants dient. Weiterhin wirkt es als starke Lewis-Säure sowie in der organischen Synthese (hier meist wasserfrei) als Katalysator bei Dehydrierungen, Polymerisationen und Friedel-Crafts-Reaktionen (Friedel-Crafts-Alkylierung, Friedel-Crafts-Acylierung). Außerdem wird es als Halogenüberträger und Kondensationsmittel verwendet.
Gegen leichte Entzündungen im Rachenraum werden Aluminiumchlorid- oder Aluminiumchlorat-haltige Lösungen zum Gurgeln angeboten. Es ist in Apotheken und Drogerien frei verkäuflich.
Aluminiumchlorid dient in der Dünnschichtchromatographie in Form eines Sprühreagenz zum Nachweis von Flavonoiden. Dazu werden 2,0 g Aluminiumchlorid-Hexahydrat in 100 mL einer 5%igen Lösung (V/V) von Eisessig in Methanol gelöst. Nach dem Aufsprühen dieser Lösung auf die DC-Platte erfolgt die Betrachtung im UV365-Licht. Dieses Reagenz wird unter der Bezeichnung Aluminiumchlorid-Reagenz R imEuropäischen Arzneibuch (Ph. Eur.) gelistet.
Sicherheitshinweise
Aluminiumchlorid wurde 2014 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Aluminiumchlorid waren die Besorgnisse bezüglich Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage und hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Substanzen. Die Neubewertung läuft seit 2015 und wird von Frankreich durchgeführt. Um zu einer abschließenden Bewertung gelangen zu können, wurden weitere Informationen nachgefordert.
Handelspräparate
- Monopräparate
AHC20 (CH), AHC30 (CH), Everdry (D), Gargarisma zum Gurgeln (D), Mallebrin (Ursprünglicher Wirkstoff Aluminiumchlorat) (D), Never-Sweat (D), Odaban (GB), Seven days (D), Sweat Protect (D), Yerka (D), Purax (D)


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 02.04. 2025
