
Borane
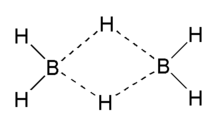
Borane sind Borwasserstoffverbindungen („Borhydride“) und deren Derivate. Die einfachste Verbindung dieser Stoffklasse ist das Diboran B2H6. Dieses liegt im Gleichgewicht mit Monoboran, das aufgrund seiner Hypovalenz dimerisiert, sodass das Gleichgewicht weit auf der Seite des Diborans liegt.
Geschichte
Über die erste gasförmige Substanz, die als Hydrid des Bors beschrieben wurde und mit grüner Flamme verbrannte, berichteten 1881 F. Jones und R. L. Tylor. Dieses Gas entstand durch Einwirken von Salzsäure auf Magnesiumborid. Im weiteren Verlauf der Untersuchungen wurden verschiedene Formeln für diese Verbindung vorgeschlagen, so BH3. Erst Alfred Stock, der die Boran-Chemie in den Jahren um den Ersten Weltkrieg ausbaute, führte die ersten genaueren Untersuchungen durch und veröffentlichte 1912 die Ergebnisse, dass das bei der Reaktion von Magnesiumdiborid mit Salzsäure entstandene Gas ein Gemisch von B4H10 und B6H12 sei. Später erwies sich das von Stock beschriebene B6H12 als ein Gemisch von B4H10, B5H9 und B6H10. Erst 1964 wurde von D.F. Gaines und R. Schaeffer das reine B6H12 synthetisiert. Während des Zweiten Weltkrieges wurden die Forschungen, insbesondere die Synthesemöglichkeiten, von Hermann Irving Schlesinger und Herbert Charles Brown verstärkt betrieben, weil die Borane im Zusammenhang mit der Urananreicherung (als U(BH4)4) und als Raketentreibstoff auf Interesse stießen.
Lange Zeit wurde am Strukturproblem des Diborans B2H6 gearbeitet und Vorschläge für Strukturformeln über die klassische Valenztheorie gemacht. Endgültige Klärungen brachten 1947 und 1951 Untersuchungen mit einem hochauflösenden Infrarotspektrometer beziehungsweise mit Röntgenstrukturanalysen mit Einkristallen bei tiefen Temperaturen. Diese Untersuchungen führten zum Bruch mit dem klassischen Valenzstrich-Konzept und unter Einbeziehung der Molekülorbitaltheorie zu der Formulierung als BHB-Dreizentrenbindung neben den terminalen BH-Zweizentrenbindungen.
Eigenschaften
Die Chemie der Borane und der verwandten Carbaborane sowie Metallaborane ist eines der vielfältigsten Entwicklungsfelder in der anorganischen Chemie. Zahlreiche neutrale Borane BnHm, Borananionen BnHmy− und Borankationen BnHmx+ wurden synthetisiert.
Borane sind Elektronenmangelverbindungen, da mehr Atome kovalent miteinander verknüpft sind, als Elektronenpaare vorhanden sind. Dies führt zu ungewöhnlich hohen Bindungsordnungen und Koordinationszahlen. Maßgeblich sind hierfür Mehrzentrenbindungen, zumeist Dreizentrenbindungen.
Man unterscheidet die Borane nach Stöchiometrie und Struktur in hypercloso-, closo-, nido-, arachno-, hypho-, commo- und conjuncto-Borane. Die Geometrie dieser Boranstrukturen ist durch das Verhältnis der Anzahl der Gerüstelektronen zur Anzahl der Gerüstatome bestimmt. Die Strukturen lassen sich mit der Wade-Regel, für kompliziertere, ineinander verquickte Boran-Cluster (z.B. commo-Borane) mit der mno-Regel nach Balakrishnarajan und für sehr große Borane mit der (6m+2n)-Regel nach Paul von Ragué Schleyer bestimmen.
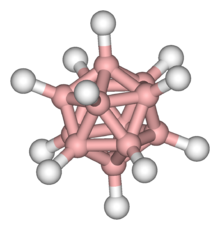
Insbesondere die closo-Borane wie B6H62−, B9H92−, B10H102−, B12H122−, B21H18− und B20H16 sind im Vergleich mit simpleren Boranen wie B2H6 oder B10H14 sehr stabil. Diese Stabilität beruht hauptsächlich auf sterischen Effekten, hoher Symmetrie und darauf, dass die geschlossenen Käfigstrukturen der closo-Borane ohne verbrückende Wasserstoffe aufgebaut sind. So besitzt B12H122− die Struktur des besonders stabilen B12-Ikosaeders, das die Basis der verschiedenen Bor-Modifikationen bildet. William Lipscomb erhielt für seine Arbeiten über Borane und Carbaborane 1976 den Nobelpreis für Chemie.
Die Umsetzung von Diboran B2H6 mit Sauerstoff zu Bortrioxid B2O3 ist eine der stärksten exothermen Reaktionen, die bekannt sind. Dies weckte vor allem Interesse beim Militär wegen eines Einsatzes als Raketentreibstoff, sodass in diesem Bereich intensive Grundlagenforschung betrieben wurde. Nach 15 Jahren wurde die militärische Forschung wegen unterschiedlicher Probleme eingestellt: die an der Reaktion beteiligten Stoffe sind instabil, geruchsintensiv, giftig und vor allem klebrig, was eine Verwendung in Triebwerken ausschließt.
Die Salze von Boranen werden als Boranate, Hydroborate oder Hydridoboranate, die entsprechenden Anionen als Boranat-Ionen (Monoboranat/Tetrahydroboranat/Tetrahydridoboranat BH4−, Diboranat B2H7− und Dekaboranat B10H10−) bezeichnet. Sie werden als Reduktions- und Hydrierungsmittel eingesetzt. Wichtige Vertreter sind Natriumboranat und Lithiumboranat. Natriumboranat entsteht durch Reaktion von Natriumhydrid mit Diboran.
Herstellung im Labor
Boran kann als Tetrahydrofuran-Komplex (BH3·THF) leicht aus Natriumboranat und elementarem Iod in situ hergestellt werden.
Der Boran-Tetrahydrofuran-Komplex ist kommerziell erhältlich.
Ebenso ist die Darstellung durch Umsetzung von Bortrifluorid mit Natriumhydrid oder Lithiumhydrid möglich:
Höhere Borane werden aus dem Diboran B2H6 über Reaktionen bei höheren Temperaturen, die dem Reforming-Prozess ähneln, hergestellt.
B12H122− lässt sich aus Bortrioxid, Natrium und Wasserstoff bei 600–850 °C im Autoklaven herstellen:
Verwendung
In der organischen Synthese hat Boran zwei Hauptanwendungen. Zum ersten die von Herbert Charles Brown entdeckte und erforschte Hydroborierung, für deren systematische Untersuchung er 1979 den Nobelpreis für Chemie erhielt. Bei dieser Reaktion wird formal Wasser in einer Anti-Markownikow-Addition an eine Kohlenstoff-Kohlenstoff-Doppelbindung addiert. Eine weitere wichtige Verwendung findet Boran bei der Reduktion von Carbonsäuren beziehungsweise deren Derivaten zu primären Alkoholen.
Weiterhin kann Boran durch Reaktion mit Ammoniak zur Herstellung von Amminboran verwendet werden, welches als Speichersubstanz für Wasserstoffgas für Fahrzeuge diskutiert wird.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 30.10. 2024