1,3-Propandiol
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
1,3-Propandiol (PDO) ist eine chemische Verbindung. Sie besteht aus dem Grundgerüst des Propans, an dessen terminalen Positionen sich jeweils eine Hydroxygruppe befindet. 1,3-Propandiol gehört zur Gruppe der zweiwertigen Alkohole, der Diole.
Gewinnung und Darstellung
1,3-Propandiol ist über eine Vielzahl von Möglichkeiten synthetisch zugänglich. Eine Möglichkeit besteht in der Hydratisierung von Acrolein mit verdünnter Schwefelsäure in Gegenwart von Hydrochinon (verhindert die Polymerisation des Acroleins) und anschließender Hydrierung mit Raney-Nickel als Katalysator.[6] Die Herstellung kann auch aus 3-Hydroxypropionsäure erfolgen.[7]
| Strukturformel | ||
|---|---|---|
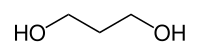
| ||
| Allgemeines | ||
| Name | 1,3-Propandiol | |
| Andere Namen | ||
| Summenformel | C3H8O2 | |
| Kurzbeschreibung | farb- und geruchslose Flüssigkeit[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 504-63-2 | |
| EG-Nummer | 207-997-3 | |
| ECHA-InfoCard | 100.007.271 | |
| PubChem | 10442 | |
| ChemSpider | 13839553 | |
| DrugBank | DB02774 | |
| Eigenschaften | ||
| Molare Masse | 76,10 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 1,05 g/cm3 (20 °C)[3] | |
| Schmelzpunkt | −26 °C[3] | |
| Siedepunkt | 213 °C[3] | |
| Dampfdruck | ||
| Löslichkeit | vollständig mischbar mit Wasser[3][2] | |
| Brechungsindex | 1,4383[4] | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −480,8 kJ/mol[5] | |
Auch eine biochemische Synthese von 1,3-Propandiol aus nachwachsenden Rohstoffen ist möglich. Natürlicherweise kann es durch die Vergärung von Glycerin durch viele anaerobe Bakterien gebildet werden. Mögliche Gattungen sind Citrobacter, Clostridium, Enterobacter, Klebsiella und Lactobacillus. Industriell wird ein Escherichia coli-Stamm genutzt, der durch starke genetische Veränderungen Glucose zu 1,3-Propandiol vergären kann. Als Rohstoff wird Mais genutzt. 2013 ging knapp die Hälfte der Gesamtproduktion auf diese Herstellungsart zurück.[8]
Eigenschaften
Physikalische Eigenschaften
Es handelt sich um eine farblose, hygroskopische Flüssigkeit mit nur schwachem Eigengeruch, die bei 213 °C siedet.[3] Sie ist mischbar mit Wasser, Alkoholen, Ethern und Formamid, und ist wenig löslich in Benzol und Chloroform.[9]
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in kPa, T in K) mit A = 8,34759, B = 3149,87 und C = 9,1444.[10] Die Verbindung ist schwer entzündbar.[3] Sie bildet oberhalb ihres Flammpunktes entzündliche Dampf-Luft-Gemische. Der Flammpunkt beträgt 128 °C.[3] Die untere Explosionsgrenze liegt bei etwa 2,5 Vol.‑% (79 g/m3).[3] Die Zündtemperatur beträgt 400 °C.[3] Der Stoff fällt somit in die Temperaturklasse T2.
Chemische Eigenschaften
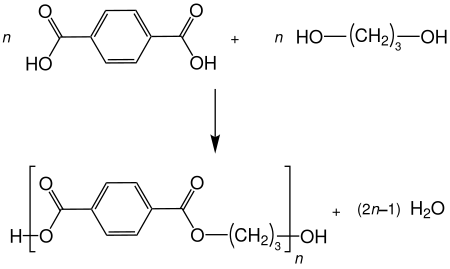
1,3-Propandiol geht viele typische Reaktionen von Alkoholen ein, wie beispielsweise Veretherungen und Veresterungen. Dabei sind beide Hydroxygruppen gleich reaktiv. Als Diol kann 1,3-Propandiol auch Polykondensationen eingehen. Ein Beispiel ist die Bildung des Polyesters Polytrimethylenterephthalat (PTT) mit Terephtalsäure[11]:
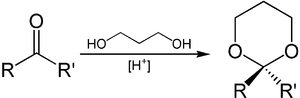
1,3-Propandiol kann zur Einführung von Schutzgruppen an Aldehyden und Ketonen genutzt werden.[12] Aus der eingesetzten Carbonylverbindung wird unter sauren Bedingungen ein Derivat von 1,3-Dioxan, ein Acetal beziehungsweise Ketal, gebildet. Dieses ist stabil gegenüber basischen Bedingungen und kann, wenn der Schutz nicht mehr benötigt wird, durch Einwirkung von Brønsted- oder Lewis-Säuren in Anwesenheit von Wasser wieder gespalten werden.
Auch die Synthese von 1,3-Dioxan selbst gelingt durch Umsetzung von 1,3-Propandiol mit Formaldehyd und Phosphorsäure.[13] Diese Reaktion kann auch unter Verwendung von Salzsäure und Urotropin durchgeführt werden.[14]
Verwendung
1,3-Propandiol wird hauptsächlich zur Herstellung des Polyesters Polytrimethylenterephthalat (PTT) genutzt.[8] Daneben gibt es zahlreiche weitere Anwendungen in der Polymerchemie: Es wird zur Herstellung von Polycarbonat und Polymerisationskatalysatoren sowie als Vernetzungsmittel für Polyacrylate und Polymethacrylate benutzt.[15] Außerdem ist es Ausgangssubstanz für Verbindungen, die in der Herstellung von Polyurethanen, Epoxidharzen und Kautschuk benutzt werden.[15][16] Weitere Anwendungen in der Polymerchemie, wie z. B. als Baustein in Beschichtungen oder als biobasierte Alternative zu anderen Diolen, diskutiert.[17]
Außerhalb der Polymerchemie kann 1,3-Propandiol auch als Frostschutzmittel und als Kühlmittel genutzt werden.[9] Darüber hinaus dient es zur Herstellung von UV-stabilen Lacken bei denen das Verhältnis von Elastizität und Härte ausgewogen ist und ist in Kosmetika, Drucktinten und Beschichtungsmaterialien enthalten.[15]
Siehe auch
Einzelnachweise
- ↑ Eintrag zu
 PROPANEDIOL
in der CosIng-Datenbank der EU-Kommission.
PROPANEDIOL
in der CosIng-Datenbank der EU-Kommission.
- ↑ Hochspringen nach: a b Eintrag zu Propandiole. In: Römpp Online. Georg Thieme Verlag.
- ↑ Hochspringen nach: a b
c d e
f g h
i j k
l Eintrag zu
 CAS-Nr. 504-63-2 in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
CAS-Nr. 504-63-2 in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
- ↑ M. Bergmann, A. Miekeley, E. v. Lippmann: Zur Chemie assoziierender Lactolide: Über Umwandlungen der Aldole.
In: Chemische Berichte 62, 1929, S. 1467–1474.
 doi:10.1002/cber.19290620616.
doi:10.1002/cber.19290620616.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-25.
- ↑ C. H. Werkman, G. F. Gillen: Bacteria Producing Trimethylene Glycol. In: Journal of Bacteriology 23, 1932, S. 167–182.
- ↑ Cristina Della Pina, Ermelinda Falletta, Michele Rossi:
A green approach to chemical building blocks. The case of 3-hydroxypropanoic acid. In: Green Chemistry. 13, 2011, S. 1624,
doi:
 10.1039/C1GC15052A.
10.1039/C1GC15052A.
- ↑ Hochspringen nach: a b Peter Dürre:
Technische Alkohole und Ketone. In: Hermann Sahm, Garabed Antranikian, Klaus-Peter Stahmann & Ralf Takors (Hrsg.):
Industrielle Mikrobiologie. Springer Spektrum, Berlin, Heidelberg 2013, ISBN 978-3-8274-3039-7,
Kap. 4,
S. 77–81,
doi:
 10.1007/978-3-8274-3040-3.
10.1007/978-3-8274-3040-3.
- ↑ Hochspringen nach: a b Carl J. Sullivan, Anja Kuenz &
Klaus-Dieter Vorlop: Propanediols. In: Ullmann’s Encyclopedia of industrial chemistry. Wiley-VCH,
Weinheim 2018,
doi:
 10.1002/14356007.a22_163.pub2.
10.1002/14356007.a22_163.pub2.
- ↑ E. Hala, J. Pick, V. Fried, O. Vilim: Vapor-Liquid Equilibrium. 2. Auflage. Pergamon Press, Oxford 1967.
- ↑ Helmut Sattler & Michael Schweitzer: Fibers, 5.
Polyester Fibers. In: Ullmann’s Encyclopedia of industrial chemistry. Wiley-VCH, Weinheim 2011,
S. 25–27,
doi:
 10.1002/14356007.o10_o01.
10.1002/14356007.o10_o01.
- ↑ E. J. Salmi: Untersuchungen über ätherartige Verbindungen, I. Mitteil.: Zur Darstellung der Acetale und
Ketale. In: Chemische Berichte 71, 1938, S. 1803–1808.
 doi:10.1002/cber.19380710905.
doi:10.1002/cber.19380710905.
- ↑ R. Leutner: Zur Hydrolysegeschwindigkeit zyklischer Azetale. In: Monatshefte für Chemie 60, 1932, S. 317–352. doi:10.1007/BF01538573
- ↑ Patent
 US2021680: Preparation of methylene ethers. Angemeldet am 29. Juli 1930,
veröffentlicht am 19. November 1935, Anmelder: Imperial Chemical Industries, Erfinder: Samuel Coffey.
US2021680: Preparation of methylene ethers. Angemeldet am 29. Juli 1930,
veröffentlicht am 19. November 1935, Anmelder: Imperial Chemical Industries, Erfinder: Samuel Coffey.
- ↑ Hochspringen nach: a b c Eintrag zu Propandiole. In: Römpp Online. Georg Thieme Verlag.
- ↑ Oliver Türk: Stoffliche Nutzung nachwachsender Rohstoffe. Springer Vieweg, Wiesbaden, 2014, ISBN 978-3-8348-1763-1, S. 417–418.
- ↑ Marcel Kluge, Sacha Pérocheau Arnaud & Tobias Robert:
1,3‑Propanediol and its Application in Bio‑Based Polyesters for Resin Applications. In: Chemistry Africa.
Band 2, 2019,
S. 215–221,
doi:
 10.1007/s42250-018-0026-4.
10.1007/s42250-018-0026-4.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.10. 2025