
Raney-Nickel

Raney-Nickel ist ein fester Katalysator, der aus feinen Körnern einer Nickel-Aluminium-Legierung besteht und in vielen industriellen Prozessen eingesetzt wird. Raney-Nickel wurde 1926 vom amerikanischen Ingenieur Murray Raney als alternativer Katalysator zur Hydrierung von Pflanzenölen entwickelt.[1] In modernen Prozessen wird Raney-Nickel als heterogener Katalysator bei vielen Synthesen komplexer organischer Moleküle wie z. B. Naturstoffen bei Hydrierungsreaktionen verwendet.
Raney-Nickel entsteht durch Auslaugen eines Aluminium-Nickel-Blocks mittels konzentrierter Natronlauge. Diese „Aktivierung“ löst einen Großteil des Aluminiums aus der Legierung und hinterlässt eine poröse Struktur, die aufgrund ihrer großen Oberfläche chemische Reaktionen stark beeinflussen kann. Ein typischer Katalysator besteht zu etwa 85 % der Masse aus Nickel, was etwa zwei Nickelatomen je Aluminiumatom entspricht.
Raney-Nickel ist pyrophor, d. h., es beginnt bei Kontakt mit Sauerstoff zu brennen.
Herstellung
Die Legierung
Kommerziell wird die Legierung durch gemeinsames Schmelzen des aktiven Metalls – in diesem Fall Nickel, zur Herstellung anderer Raney-artiger Katalysatoren können auch Eisen und Kupfer verwendet werden – und Aluminium in einem Tiegel mit anschließendem Abschrecken hergestellt. Das resultierende Metall wird zu einem feinen Pulver zermahlen[2] und anschließend die gewünschten Partikelgrößen herausgesiebt.
Die anfängliche Zusammensetzung der Legierung ist entscheidend, da das Abschrecken verschiedene Ni/Al-Phasen bewirkt, die sich in Laugen unterschiedlich verhalten. Hierdurch kann die resultierende Porosität des Endprodukts große Schwankungen aufweisen. Zumeist weist die Ausgangslegierung gleiche Gewichtsanteile Nickel und Aluminium auf, was das gleiche Verhältnis ist, das Murray Raney bei Entdeckung des Raney-Nickel verwendete.
Während des Abschreckens können kleine Mengen eines dritten Metalls, etwa Zink oder Chrom, verwendet werden. Dieses zusätzliche Metall steigert die katalytische Aktivität und wird daher als „Promotor“ bezeichnet.[2] Durch den Promotor verändert sich jedoch die Legierung und sein Phasendiagramm zu einer Dreifachlegierung, was neben einem anderen Verfahren der Abschreckung auch verändertes Verhalten während der Aktivierung nach sich zieht.
Der Aktivierungsprozess
Die poröse Struktur des Katalysators entsteht durch Auslösen des Aluminiums durch Natronlauge. Die vereinfachte Laugenreaktion wird durch folgende Reaktionsgleichung gegeben:
Das hierbei auftretende Natriumaluminat (Na[Al(OH)4]) erzwingt die Verwendung von konzentrierten Natronlaugen, um ein Ausfällen von Aluminiumhydroxid in Form von Bayerit zu verhindern.[2] Die Laugen haben hierbei Konzentrationen bis zu 5 mol/l. Das Bayerit kann die Poren der gebildeten Struktur verstopfen und aufgrund der hierdurch reduzierten Oberfläche die Effizienz und Aktivität des Katalysators negativ beeinflussen.
Die Temperatur der Lauge hat ebenso einen deutlichen Einfluss auf die Oberflächeneigenschaften des Katalysators, wobei übliche Temperaturen von 70 bis zu 100 °C reichen. Bei Raney-Nickel und Raney-artigen Katalysatoren verkleinert steigende Temperatur während des Aktivierungsprozesses die resultierende Oberfläche.[3] Dies liegt an strukturellen Umformungen innerhalb der Legierung, die ähnlich dem Sintern ablaufen.
Vor der Lagerung wird der Katalysator mit destilliertem Wasser bei Raumtemperatur gewaschen, um verbleibende Restspuren Natriumaluminat zu beseitigen. Sauerstoffarmes Wasser wird zur Lagerung bevorzugt, um Oxidation des Katalysators zu unterbinden, die dessen Alterung beschleunigt und die katalytische Wirkung mindert.[2]
Eigenschaften


Makroskopisch sieht Raney-Nickel wie ein fein zerteiltes graues Pulver aus. Mikroskopisch hingegen ähnelt jeder Partikel einem dreidimensionalen Gitter, dessen Öffnungen – Poren irregulärer Größe und Form – überwiegend durch die Auslaugung geschaffen werden. Raney-Nickel ist thermisch und strukturell stabil und besitzt eine große BET-Oberfläche. Diese Eigenschaften resultieren hauptsächlich aus dem Aktivierungsprozess und tragen zur vergleichsweise hohen katalytischen Wirksamkeit bei.
Während der Aktivierung wird das Aluminium aus den NiAl3- und Ni2Al3-Phasen der Legierung ausgelöst, verbleibendes Aluminium hat zumeist die Form NiAl. Diese Entfernung des Aluminiums aus spezifischen Phasen wird als „selektives Auslaugen“ bezeichnet. Die NiAl-Phase unterstützt hierbei die strukturelle und thermische Stabilität des Katalysators, der hierdurch resistent gegenüber Zersetzung ist.[3] Diese Resistenz erlaubt es dem Raney-Nickel, für längere Zeit gelagert und verwendet zu werden; für die Labornutzung werden jedoch meist frische Präparate verwendet. Aus diesem Grunde wird kommerzielles Raney-Nickel sowohl in „aktiver“ als auch „inaktiver“ Form angeboten.
Die Oberfläche wird häufig mittels BET-Messungen ermittelt, wofür ein hauptsächlich durch metallische Oberflächen adsorbiertes Gas – etwa Wasserstoff – verwendet wird. Über derartige Messungen wurde demonstriert, dass nahezu die gesamte exponierte Oberfläche der Partikel aus Nickel besteht.[2] Da Nickel das aktive Metall des Katalysators ist, wird so eine große Fläche für chemische Reaktionen geboten, was sich in der katalytischen Wirksamkeit niederschlägt. Kommerziell erhältliches Raney-Nickel weist eine durchschnittliche Nickeloberfläche von 100 m2 pro Gramm auf.[2]
Durch die hohe Wirksamkeit und die Adsorption von Wasserstoff innerhalb der Poren ist Raney-Nickel ein geeigneter Katalysator in vielen Hydrierungsreaktionen. Seine Stabilität – etwa die Tatsache, dass es sich nicht bei hohen Temperaturen zersetzt – erlaubt zudem eine große Bandbreite an Reaktionsbedingungen. Mit Ausnahme von Mineralsäuren – beispielsweise Salzsäure – ist Raney-Nickel in den meisten Laborlösungsmitteln kaum löslich und erleichtert durch seine hohe Dichte, die zwischen 6 und 7 g/cm3 liegt, die Trennung von flüssigen Phasen nach einer Reaktion.
Die Partikelgröße beträgt normalerweise 20 bis 50 µm, in Sonderfällen auch 10 µm oder bis zu 90 µm.
Anwendungen
Raney-Nickel wird aufgrund seiner Stabilität und Wirksamkeit bei Raumtemperatur in einer Vielzahl industrieller Prozesse und Laborsynthesen verwendet.[2][4] Es wird typischerweise in der Reduktion von Komponenten mit Mehrfachbindungen verwendet – etwa Alkine, Alkene[5], Nitrile[6], Polyene, Aromaten[7] und Stoffen der Carbonylgruppe. Zusätzlich reduziert Raney-Nickel Heteroatom-Heteroatom-Bindungen wie organische Nitroverbindungen und Nitrosamine.[8] Die Alkylierung von Aminen und die Aminierung von Alkoholen stellt ein weiteres Anwendungsgebiet dar.[9]
Ein Beispiel für die Anwendung von Raney-Nickel in der Industrie ist die folgende Reaktion, hier wird Benzol zu Cyclohexan reduziert. Reduktion der aromatischen Struktur des Benzolrings ist mit anderen chemischen Methoden nur schwer zu erreichen, lässt sich jedoch mittels Raney-Nickel erzielen. Andere heterogene Katalysatoren, etwa solche, die Elemente der Eisen-Platin-Gruppe nutzen, können ebenso genutzt werden, sind jedoch zumeist teurer als Raney-Nickel. Nach dieser Reaktion kann Cyclohexan etwa zur Synthese von Adipinsäure verwendet werden, einem Rohmaterial zur Produktion von Polyamiden wie Nylon.[10]
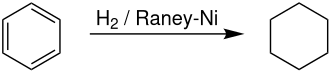
Bei der Reduktion von Kohlenstoff-Kohlenstoff-Doppelbindungen fügt Raney-Nickel Wasserstoff hinzu (Addition).[11] Neben der Nutzung als Katalysator kann Raney-Nickel auch als Reagenz zur Entschwefelung organischer Verbindungen genutzt werden.[11] Beispielsweise werden Thioacetale zu Kohlenwasserstoffen reduziert:[10]
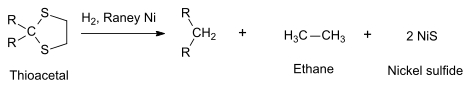
Nickelsulfid fällt aus, während Ethan als Gas entweichen kann. Ähnliche Transformationen sind die Clemmensen-Reduktion und die Wolff-Kishner-Reaktion. Auch Phosphinsulfide lassen sich mit Raney-Nickel bei Raumtemperatur zu den freien Phosphinen entschwefeln.[12]
Einzelnachweise
- ↑ Patent US1628190A: Method of producing finely-divided nickel. Veröffentlicht am 10. Mai 1927, Erfinder: Murray Raney.
- ↑ Hochspringen nach: a b c d e f g Ertl, Gerhard; Knözinger, Helmut (Eds.) (1997). Preparation of Solid Catalysts, Weinheim: Wiley. ISBN 3-527-29826-6.
- ↑ Hochspringen nach: a b A. J. Smith, D. L. Trimm: The preparation of skeletal catalysts. In: Annual Review of Materials Research. Band 35, 2005, S. 127–142, doi:10.1146/annurev.matsci.35.102303.140758.
- ↑ Organic Syntheses (2005). „Raney nickel usage in Organic Syntheses“
- ↑ Page, G. A.; Tarbell, D. S.: β-(o-Carboxyphenyl)propionic acid In: Organic Syntheses. 34, 1954, S. 8, doi:10.15227/orgsyn.034.0008; Coll. Vol. 4, 1963, S. 136 (PDF).
- ↑ Robinson, Jr., H. C.; Snyder, H. R.: β-Phenylethylamine In: Organic Syntheses. 23, 1943, S. 71, doi:10.15227/orgsyn.023.0071; Coll. Vol. 3, 1955, S. 720 (PDF).
- ↑ Schwenk, E.; Papa, D.; Hankin, H.; Ginsberg, H.: γ-n-Propylbutyrolactone and β-(Tetrahydrofuryl)propionic acid In: Organic Syntheses. 27, 1947, S. 68, doi:10.15227/orgsyn.027.0068; Coll. Vol. 3, 1955, S. 742 (PDF).
- ↑ Enders, D.; Pieter, R.; Renger, B.; Seebach, D.: Nucleophilic α-sec-aminoalkylation: 2-(diphenylhydroxymethyl)pyrrolidene In: Organic Syntheses. 58, 1978, S. 113, doi:10.15227/orgsyn.058.0113; Coll. Vol. 6, 1988, S. 542 (PDF).
- ↑ Rice, R. G.; Kohn, E. J.: N,N'-Diethylbenzidene In: Organic Syntheses. 36, 1956, S. 21, doi:10.15227/orgsyn.036.0021; Coll. Vol. 4, 1963, S. 283 (PDF).
- ↑ Hochspringen nach: a b c Solomons, T.W. Graham; Fryhle, Craig B. (2004). Organic Chemistry (8th Edn.), Wiley International Edition. ISBN 0-471-41799-8
- ↑ Gassman, P. G.; van Bergen, T. J.: Indoles from anilines: Ethyl 2-methylindole-5-carboxylate In: Organic Syntheses. 56, 1977, S. 72, doi:10.15227/orgsyn.056.0072; Coll. Vol. 6, 1988, S. 601 (PDF).
- ↑ Wenjun Tang, Weimin Wang, Xumu Zhang: Phospholane–Oxazoline Ligands for Ir-Catalyzed Asymmetric Hydrogenation. In: Angewandte Chemie International Edition. Band 42, Nr. 8, 24. Februar 2003, S. 943–946, doi:10.1002/anie.200390251.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.09. 2024