
Acetale
| Acetale |
 |
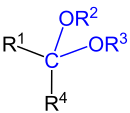 |
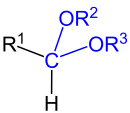
Acetale sind chemische Verbindungen mit zwei Alkoxy- oder Aryloxygruppen (–OR) am selben Kohlenstoff-Atom. Damit zählen sie zu den geminalen Diethern. Die Bezeichnung für diese Stoffgruppe geht auf Acetaldehyddiethylacetal zurück, das anfangs einfach Acetal genannt wurde.
Acetale leiten sich formal von Aldehyden bzw. Ketonen ab, wobei ursprünglich zwischen den aus Aldehyden gebildeten Diethern (mit einem H-Atom) und den aus Ketonen gebildeten Diethern (Ketalen) unterschieden wurde. Heutzutage werden nach IUPAC Ketale meist als Unterklasse der Acetale betrachtet.
Bei der Bildung von Acetalen entstehen als Zwischenprodukte die Semi- bzw. Halbacetale, die in Anwesenheit von Säuren weiter zu Acetalen reagieren.
Synthese
Acetale bilden sich bei Umsetzung von Aldehyden oder Ketonen mit Alkoholen. Die Reaktion erfolgt in der Regel säurekatalysiert unter Abspaltung von Wasser. Als Zwischenstufe entstehen Halbacetale, wie die folgende beispielhafte Reaktion von Acetaldehyd und Methanol zeigt:
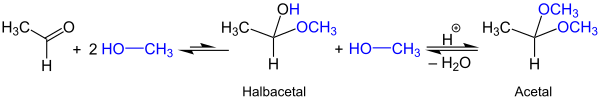
Bei Verwendung von zweiwertigen Alkoholen (Diolen) läuft der zweite Schritt dieser Reaktion intramolekular ab und es entstehen cyclische Acetale. Die Zugabe einer verdünnten Säure führt zur Hydrolyse der Acetale, so dass das Gleichgewicht der obigen Reaktion nach links verschoben wird.
Acetale als Schutzgruppen
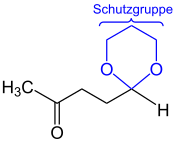
In der Synthesechemie werden insbesondere cyclische Acetale oft als Schutzgruppen für Carbonylgruppen benutzt. Dabei wird die hohe Beständigkeit der Acetale gegenüber Basen, Reduktions- und Oxidationsmitteln ausgenutzt, um die Carbonylgruppe beispielsweise vor Oxidation zu schützen. Nach Durchführung der gewünschten Reaktion im alkalischen Milieu kann durch Ansäuerung die Abspaltung des Diols und damit die Rückbildung der Carbonylverbindung erreicht werden. Umgekehrt können auch Diole als Acetale geschützt werden. Hier wird häufig Aceton als Carbonylkomponente verwendet, da so kein stereogenes Zentrum am Acetalkohlenstoff erzeugt wird. Die Produkte dieser Reaktion werden Acetonide genannt.
Verwandte Verbindungen
O,N-Acetale
Wenn die Carbonylgruppe eines Aldehyds oder eines Ketons mit einem 1,2-Aminoalkohol unter Wasserabspaltung umgesetzt wird, entsteht ein N,O-Acetal.
Thioacetale
Acetale können auch mit Thiolen gebildet werden, diese nennt man Thioacetale (genauer: Dithioacetale, da beide Sauerstoffatome des Acetals durch Schwefelatome ersetzt werden). Sie unterscheiden sich in der Reaktivität von den Acetalen, was synthetischen Nutzen haben kann (Corey-Seebach-Reaktion). Setzt man einen Aldehyd oder ein Keton unter Säurekatalyse jedoch mit einem Alkohol des Typs HO–CH2–CH2–SH um, so erhält man unter Wasserabspaltung ein Monothioacetal.
S,N-Acetale
Wenn die Carbonylgruppe eines Aldehyds oder eines Ketons mit einem 1,2-Aminothiol unter Wasserabspaltung umgesetzt wird, entsteht ein N,S-Acetal. Thiazolidine und 3-Thiazoline sind Beispiele für heterocyclische N,S-Acetale.
Siehe auch
Verbindungen, in denen drei Alkoxygruppen oder Aryloxygruppen –OR an dasselbe Kohlenstoff-Atom gebunden sind, werden Orthoester genannt und zählen nicht zu den Acetalen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 07.11. 2025