
Fullerene
.png)

Als Fullerene (Einzahl: das Fulleren) werden hohle, geschlossene Moleküle (mit häufig hoher Symmetrie, z.B. Ih-Symmetrie für C60) aus Kohlenstoffatomen, die sich in Fünf- und Sechsecken anordnen, bezeichnet. Sie stellen (neben Diamant, Graphit, Lonsdaleit, Chaoit, Kohlenstoffnanoröhren und Graphen) eine weitere Modifikation des chemischen Elements Kohlenstoff dar.
Geschichte
Die erste Veröffentlichung zu Fullerenen erfolgte bereits im Jahr 1970 von dem japanischen Chemiker Eiji Ōsawa, der ihre Existenz theoretisch vorhersagte und berechnete. Diese und folgende seiner Publikationen veröffentlichte er in japanischer Sprache, weswegen erst die 15 Jahre später am 14. November 1985 in der Zeitschrift Nature erschienene Publikation der Forscher Robert F. Curl jr. (USA), Sir Harold W. Kroto (England) und Richard E. Smalley (USA) weltweite Aufmerksamkeit erlangte. Diese erhielten dafür 1996 den Nobelpreis für Chemie, während Osawa unberücksichtigt blieb.
Vor diesen Veröffentlichungen zu Fullerenen gab es einige zu „Hohlmolekülen“, beispielsweise einen Artikel von David Jones im New Scientist 1966, nachgedruckt auch im Buch „Zittergas und schräges Wasser“ (S. 27 f.), mit Rechnungen zur Stabilität von Hohlmolekülen, wobei die damals größten bekannten Moleküle nur Dodekaeder-Form hatten, also nur 20 Atome enthielten.
2010 wurden Fullerene durch Infrarotaufnahmen des Weltraumteleskops Spitzer im planetarischen Nebel Tc 1 nachgewiesen. Sie sind die bisher größten nachgewiesenen Moleküle im extraterrestrischen Weltraum.
Name
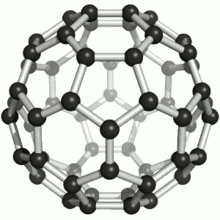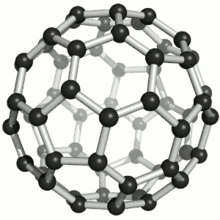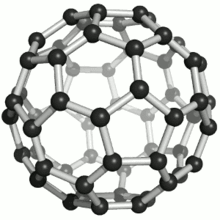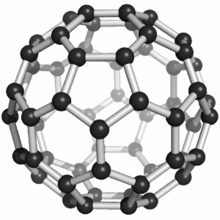
Die bekanntesten und stabilsten Vertreter der Fullerene haben die Summenformeln C60, C70, C76, C80, C82, C84, C86, C90 und C94. Das mit Abstand am besten erforschte Fulleren ist C60, das zu Ehren des Architekten Richard Buckminster Fuller Buckminster-Fulleren (auf Englisch auch buckyball) genannt wurde, da es den von ihm konstruierten geodätischen Kuppeln ähnelt. Es besteht aus 12 Fünfecken und 20 Sechsecken, die zusammen ein Abgestumpftes Ikosaeder (Archimedischer Körper) bilden. Da ein klassischer Fußball dieselbe Struktur hat, wird es auch Fußballmolekül (footballen) genannt.
Herstellung
Erstmals wurde C60 1984 von E. A. Rohlfing, D. M. Cox und A. Kaldor in Spuren „hergestellt“. Allerdings hatten die Autoren in ihrer Publikation das Ergebnis ihrer Molekularstrahlexperimente falsch interpretiert und die besondere Struktur und Wichtigkeit des Kohlenstoffclusters mit 60 Atomen nicht erkannt. Die richtige Interpretation eines vergleichbaren Experiments lieferte dann ein Jahr später die Forschergruppe Harold W. Kroto, James R. Heath, Sean C. O'Brien, Robert F. Curl und Richard E. Smalley 1985. Sie stellten dabei erstmals die Hypothese der Fußballform des derart nachgewiesenen C60-Clusters auf.
Über eine im Vakuum drehenden Graphitscheibe hinweg wird unter hohem Druck ein kurzer Heliumpuls geblasen. Gleichzeitig wird mitten in diesen Heliumpuls die Graphitoberfläche von einem Laserpuls getroffen. Das Laserlicht hatte in dem Versuch eine Wellenlänge von 532 nm, mit dem innerhalb einer Bestrahlungszeit von 5 ns eine Energie von 30 bis 40 mJ übertragen wurde. Der Kohlenstoff des Graphits sublimiert dabei schlagartig atomar und verbindet sich in der kühlenden Heliumumgebung zu penta- und hexagonalen Ringstrukturen, die sich, während sie von dem Heliumpuls aus dem Bestrahlungsraum hinausgetrieben werden, in einer Reaktionskammer zu Kohlenstoffclustern beliebiger Größe, darunter Fullerenen, verbinden und im Massenspektrometer nachgewiesen werden. Die Ausbeute an C60 war jedoch so gering, dass die Untersuchung weiterer Eigenschaften nicht möglich war. Insbesondere blieb auch die hypothetische Fußballstruktur unbewiesen.
Die Heidelberger Experimente

Einen ersten Hinweis für die Struktur des C60-Moleküls lieferten 1988 Messungen von UV- und IR-Spektren an Spuren von Kohlestaub (Ruß) durch Wolfgang Krätschmer und Bernd Wagner. Im IR-Spektrum zeigten sich vier diskrete Linien, die mit den theoretischen Vorhersagen für C60 gut übereinstimmten. Für die Spektroskopie ausreichende Mengen an C60-Ruß produzierte erstmals Wagner durch Verdampfung von Graphit in einer Schutzgasatmosphäre von 50 Torr Argon.
1989 wurde von Konstantinos Fostiropoulos, Wolfgang Krätschmer und Donald Huffman dieses Verfahren abgewandelt und weiterentwickelt, sodass eine präparative Herstellung des vermuteten Fußballmoleküls möglich wurde. Jedoch gelang erst durch die vollständige isotopische Substitution des Kohlestaubs und der Herstellung des exotischen 13C60 im nächsten Jahr (1990) der Strukturnachweis des Fußballmoleküls. Schließlich wurde das Verfahren zur heute gebräuchlichen industriellen Herstellung ausgereift, die Fullerene aus dem Ruß isoliert und charakterisiert.
Erst dieses Heidelberger Herstellungsverfahren ermöglichte ab 1991 die Forschung an Fullerenen im großen Maßstab: Zwei Graphitelektroden werden unter reduziertem Druck in statischer Schutzgasatmosphäre (Helium oder Argon) durch Widerstandsheizung oder im Lichtbogen verdampft. Der Dampf kondensiert an der kühlenden Atmosphäre, und es bildet sich ein aufsteigender Rauch. Der so produzierte Ruß enthält bis zu 15 % Fullerene. Die generierten Fullerene können anschließend aus dem Ruß thermisch ausgetrieben werden oder lassen sich alternativ mit einem unpolaren Lösungsmittel (Benzol, Toluol, ...) herauslösen. Man kann auch die präparierte Rußprobe im Soxhlet-Extraktor extrahieren. Die gewonnene Fulleren-Mischung besteht zu ca. 90 % aus C60 und ca. 10 % C70. Dagegen entstehen höhere Fullerene nur in Spuren. Durch Chromatographie, z.B. an Aktivkohle und/oder Kieselgel, kann die Fulleren-Mischung aufgetrennt werden.
Möglich ist auch die Herstellung unter ausschließlicher Verwendung rationaler Synthesen, wobei hier im letzten Schritt eine Flash-Vakuum-Pyrolyse erfolgt. Die Ausbeute bei diesem Verfahren liegt allerdings nur bei etwa einem Prozent, weshalb es deutlich teurer als die Herstellung im Lichtbogen ist.
Die Fullerene C60 und C70 kommen natürlich in Shungit und Fulgurit aber auch molekular im Interstellaren Medium vor.
Eigenschaften
Fullerene sind braun-schwarze Pulver von metallischem Glanz. Sie lösen sich in manchen organischen Lösungsmitteln (z.B. Toluol) unter charakteristischer Färbung. Fullerene lassen sich bei ca. 400 °C sublimieren.

Verschiedene Möglichkeiten zur Verwendung als Katalysator, Schmiermittel, zur Herstellung künstlicher Diamanten, in der Medizin, als Halbleiter und Supraleiter sind Gegenstand der Forschung.
Aufgrund der Bindungsverhältnisse im Molekül kann es extrem viele Radikale aufnehmen und binden (Radikalfänger). Diese sollen für den Alterungsprozess der Haut mitverantwortlich sein. Diese Wirkung von Fullerenen ist jedoch nicht wissenschaftlich belegt.
Eine Studie von 2012 berichtet, die orale Gabe von C60 aufgelöst in Olivenöl bei Ratten zeige keine toxische Wirkung und habe die Lebensdauer der Ratten deutlich verlängert. Eine Reproduktion dieses Ergebnisses steht allerdings noch aus.
Nomenklatur
Lange Zeit weigerte sich die für verbindliche Empfehlungen zur Nomenklatur chemischer Verbindungen zuständige IUPAC, den Trivialnamen Fulleren anzuerkennen. Erst im Jahr 2002 änderte sie ihre Meinung und empfiehlt seitdem die Verwendung von Fulleran, Fulleren und Fulleroid. Das bedeutet eine erhebliche Erleichterung, denn bis dahin ist der korrekte, das heißt IUPAC-konforme Name, z.B. des [60]Fullerens (C60), folgender gewesen:
Struktur und Stabilität
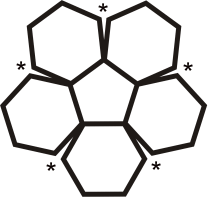
Viele Fullerene bestehen aus 12 Fünfecken, die von einer unterschiedlichen Anzahl Sechsecken umgeben sind. Durch die Unmöglichkeit, eine Ebene mit regelmäßigen Fünfecken (und Sechsecken) vollständig zu bedecken, ergibt sich die sphärische Wölbung (siehe Bild rechts). Das kleinste Fulleren ist ein Dodekaeder, C20, und besteht nur aus pentagonalen Kohlenstoffringen.
C60 hat etwa den Durchmesser 700 pm, also 7 · 10−10 m. Der Van-der-Waals-Durchmesser beträgt allerdings etwa 1000 pm, also einen Nanometer oder 1 · 10−9 m. Die Masse des C60 Fullerens beträgt etwa 720 u, außerdem hat C60 Ikosaeder-Symmetrie. Die Fullerene mit mehr als 60 C-Atomen besitzen im Allgemeinen geringere Symmetrie, C70 etwa ist annähernd ein Ellipsoid mit D5h-Symmetrie.
Die Stabilität eines Fullerens ist dann am größten, wenn
- die Fünfecke nicht aneinandergrenzen, sondern nur von Sechsecken umgeben sind (Fünfeckregel, engl.: isolated pentagon rule, IPR),
- der aromatische Charakter ausgeprägt ist (siehe Aromatizität, wobei hier allerdings die sog. sphärische Aromatizität betrachtet werden muss).
Fullerene sind eng verwandt mit Graphen, einer Modifikationen des Kohlenstoffs, bei der die C-Atome eine monomolekulare Schicht mit hexagonaler Struktur bilden. Es lässt sich folgende Reihe bilden: Graphen (nur 6-Ecke, plan) > Fullerene, allgemein (5- und 6-Ecke, gewölbtes Hohlmolekül) > C20-Fulleren (nur 5-Ecke, Dodekaeder, engste Krümmung, kleinstes Volumen).
Reaktionen von C60
Fullerene bieten drei Ansatzpunkte für chemische Modifikationen. Durch Additionsreaktionen an die Doppelbindungen erhält man exohedrale Addukte. Das Ersetzen von Kohlenstoffatomen aus der Käfighülle durch z.B. Stickstoffatome zum C59N bezeichnet man als substitutionelles Doping. Schließlich bieten derartige Käfigstrukturen noch die Möglichkeit, Atome oder Verbindungen in den Hohlraum einzubringen. Verbindungen dieser Art bezeichnet man als endohedrale Komplexe. Zur Kennzeichnung endohedraler Komplexe hat sich in der Literatur die Schreibweise X@Cn durchgesetzt, bei der sich ein Atom oder Cluster X im Inneren eines Fullerenkäfigs aus n Kohlenstoffatomen befindet.
C60 besitzt einen Hohlraum mit einem Durchmesser von 400 pm, in den Metall- und Nichtmetallatome eingelagert werden können. Ein Beispiel ist die Einlagerungsverbindung des Heliums, die mit der Notation He@C60 korrekt bezeichnet wird. He@C60 entsteht, wenn Graphit in einer Helium-Atmosphäre verdampft wird.
Weiterhin kann C60 die für Aromaten aber auch Alkene typischen Reaktionen wie Hydrierung, Halogenierung, Ozonolyse und Birch-Reduktion eingehen. Jedoch findet in der Regel keine vollständige Umsetzung aller Doppelbindungen statt; nur mit Fluor kann die Zusammensetzung C60F60 erreicht werden.
Weitere interessante Verbindungen sind die ionischen Alkalimetall-Fulleride: C60 kann mit Natrium und Kalium reduziert werden. Dabei entstehen Verbindungen der Zusammensetzung MC60, M2C60 und M3C60 (M = Na, K). KC60 kristallisiert in der Natriumchlorid-Struktur. In K3C60 liegt das C603−-Anion vor und bildet eine kubisch-dichteste Kugelpackung, wobei die K+-Kationen alle vorhandenen Tetraeder- und Oktaeder-Lücken in der Kristallstruktur besetzen. K3C60 ist ein Supraleiter.
An der Universität Wien wurde die Interferenz von C60-Molekülen am Gitter beobachtet. Damit wurden die von Louis de Broglie postulierten Materiewellen auch für relativ makroskopische Objekte gezeigt.
An der Universität Bielefeld wurden weitreichende Untersuchungen über die Funktionalisierung der Fullerene zu Aza-Heterofullerenen gemacht.
Natürliches Vorkommen
Fullerene kommen in der Natur nur in wirtschaftlich nicht verwertbaren Mengen (Konzentrationen) vor.
Mit Hilfe der Massenspektrometrie wurden Fullerene nachgewiesen im graphitartigen Shungit, im durch Blitzeinschlag entstandenen glasartigen Fulgurit, in Kratern von Meteoriteneinschlägen und im Kerzenruß.
Verwendung
C60 eignet sich als Komponente in unterschiedlichen Konzepten organischer Solarzellen (OPV – organic photovoltaic). Solche Systeme basieren auf einer Absorberschicht, die aus einer Donator-Akzeptor-Kombination besteht. Wegen seiner hohen Elektronenaffinität ist das C60-Molekül für die Rolle als Elektronenakzeptor einzigartig und wird deshalb in solchen Bauteilen fast ausschließlich eingesetzt. Als Elektronendonator stehen dagegen eine große Zahl organischer Moleküle, wie z. B. das ebenfalls thermisch stabile Zn-Phthalocyanin, und viele Polymere zur Verfügung.
Am Helmholtz-Zentrum Berlin für Materialien und Energie hatte eine Forschungsgruppe wurde 2001 eine organische Solarzelle aus C60 und Zn-Phthalocyanin, präpariert aus der Gasphase, mit einer Rekordeffizienz von η=2,5 % erreicht. Bis heute (Stand 2015) erreichen fullerenbasierte OPV-Konzepte Effizienzen bis zu 12 %. Eine industrielle Fertigung organischer Solarzellen wird angestrebt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 26.10. 2024