
Caesiumoxid
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Caesiumoxid ist eine chemische Verbindung des Caesiums und zählt zu den Oxiden. Es ist ein orangefarbener Feststoff.
Gewinnung und Darstellung
Caesiumoxid lässt sich nicht direkt aus den Elementen gewinnen, da hierbei Caesiumhyperoxid entsteht. Stattdessen können Caesiumperoxid oder Caesiumnitrat mit elementarem Caesium umgesetzt werden. Auch die Reaktion von Caesiumnitrat mit Caesiumazid zu Caesiumoxid und Stickstoff ist möglich.[4]
Eigenschaften
Caesiumoxid ist ein orangefarbener bis roter Feststoff. Bei Erhitzung erfolgt Farbvertiefung bis fast schwarz.[5] An Luft zerfließt er allmählich unter Entfärbung.[1] Er kristallisiert im Gegensatz zu den anderen Alkalimetalloxiden nicht in einer anti-Fluorit, sondern in einer trigonalen anti-Cadmiumchloridstruktur mit der Raumgruppe R3m (Raumgruppen-Nr. 166) mit den Gitterparametern a = 4,256 Å und c = 18,99 Å.[4]
Die Standardbildungsenthalpie von Caesiumoxid beträgt ΔHf0 = −346 kJ/mol.[6]
| Kristallstruktur | ||
|---|---|---|
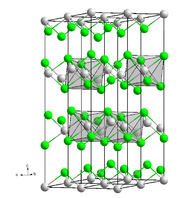
| ||
| _ O2− _ Cs+ | ||
| Allgemeines | ||
| Name | Caesiumoxid | |
| Andere Namen |
Dicaesiumoxid | |
| Verhältnisformel | Cs2O | |
| Kurzbeschreibung | orangefarbener bis roter Feststoff[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 243-679-0 | |
| ECHA-InfoCard | | |
| PubChem | | |
| Eigenschaften | ||
| Molare Masse | 281,81 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 4,65 g/cm3[2] | |
| Schmelzpunkt | 490 °C[2] | |
| Löslichkeit | reagiert heftig mit Wasser[1] | |
Verwendung
Caesiumoxid ist ein Cokatalysator für Vanadiumoxid-Titanoxid-Katalysatoren, die für Gasphasenoxidationen genutzt werden. Mit diesen können aus aromatischen Kohlenwasserstoffen Carbonsäuren und Carbonsäureanhydride hergestellt werden.[7]
Photokathoden können aus Caesiumoxid, das mit kleinen Silberpartikeln vermischt ist, hergestellt werden.[8]
Einzelnachweise
- ↑ Hochspringen nach: a b
c Jean d’Ans, Ellen Lax, Roger Blachnik: Taschenbuch für Chemiker und Physiker. Springer DE, 1998,
ISBN 3-642-58842-5, S. 414
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hochspringen nach: a b Caesiumoxid bei webelements.com.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von
 Dicesium oxide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 25. Oktober 2025.
Dicesium oxide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 25. Oktober 2025.
- ↑ Hochspringen nach: a b A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1285–1286.
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a.: Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 954.
- ↑ A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9, S. 1176.
- ↑ Patent
 EP1654061.
EP1654061.
- ↑ Yoshihiro Sayama: The Optical Theory of the Spectral Sensitivity of Caesium-Oxide Photocathode. In: Journal of the Physical Society of Japan. 2, Nr. 5, 1948, S. 103–107
(
 Abstract).
Abstract).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 25.10. 2025

