
Inosinmonophosphat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Toxikologische Daten | |||||||
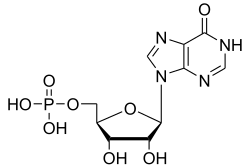
Inosinmonophosphat (IMP) ist ein Nukleotid und der Phosphorsäureester des Nukleosids Inosin. IMP ist ein zentrales Intermediat des Purinstoffwechsels in allen Lebewesen.
Eigenschaften
Farbloser Sirup mit angenehm fleischigem Geschmack (umami). Der Sirup geht bei Trocknung über Schwefelsäure in eine glasige Masse über.[4]
Physiologie
IMP ist zentrales Zwischenprodukt bei der Biosynthese der Purinnukleotide AMP und GMP sowie vollständig interkonvertibel mit beiden Stoffen.
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeines | ||
| Name | Inosinmonophosphat | |
| Andere Namen | ||
| Summenformel | C10H13N4O8P | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 205-045-1 | |
| ECHA-InfoCard | | |
| PubChem | | |
| ChemSpider | | |
| DrugBank | | |
| Eigenschaften | ||
| Molare Masse | 348,21 g/mol | |
| Aggregatzustand | fest[2] | |
| pKS-Wert | 2,4[3] | |
Biosynthese
Die Biosynthese erfolgt entweder de-novo in 11 Schritten aus α-D-Ribose-5-phosphat – der letzte Reaktionsschritt ist hierbei die Formylierung und Cyclisierung von AICAR – oder wesentlich effizienter über den Salvage-Pathway direkt aus Hypoxanthin. Katalysierende Enzyme sind dabei die AICAR-Formyltransferase/IMP-Cyclase beziehungsweise die Hypoxanthin-Guanin-Phosphoribosyltransferase.[5][6]
Weiter entsteht IMP beim Abbau von AMP durch Desaminierung mithilfe der AMP-Desaminase und durch Reduktion von GMP mittels der GMP-Reduktase.[7]
Metabolismus
IMP ist Ausgangssubstanz für die Synthese von AMP (über Adenylosuccinat) und GMP (über Xanthosin-5'-monophosphat, XMP). Es wird bei Stickstoffüberschuss über Inosin in vier Schritten zu Harnsäure abgebaut und im Urin ausgeschieden.[8]
Verwendung
Inosinmonophosphat wird wie auch das Dinatrium-, Dikalium- und Calciumsalz als Geschmacksverstärker (E 630, E 631, E 632 und E 633) eingesetzt. Trotz des geringen Eigengeschmacks besitzt Inosinmonophosphat eine ausgeprägte Wirkung als Geschmacksverstärker. Bei gemeinsamer Verwendung von Inosinmonophosphat mit Glutamat wird die geschmacksverstärkende Wirkung von Glutamat aufgrund synergistischer Effekte erheblich erhöht. Inosinmonophosphat findet als Geschmacksverstärker in Form des Natriumsalzes weit verbreitete Anwendung in der Nahrungsmittelindustrie, z. B. in Suppen- und Soßenprodukten sowie Fleischkonserven. Inosinmonophosphat wurde im Fleischextrakt bereits 1847 von Justus von Liebig nachgewiesen, der auch die geschmacksverstärkende Wirkung des Inosinmonophosphats erwähnte.[4]
Einzelnachweise
- ↑ Eintrag zu
 E 630: Inosinic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 23.Oktober 2025.
E 630: Inosinic acid in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 23.Oktober 2025.
- ↑ Hochspringen nach: a b c d Datenblatt
 Inosine 5′-monophosphate from Saccharomyces cerevisiae bei Sigma-Aldrich, abgerufen am am 23.Oktober 2025
(
Inosine 5′-monophosphate from Saccharomyces cerevisiae bei Sigma-Aldrich, abgerufen am am 23.Oktober 2025
(  PDF).
PDF).
- ↑ Hochspringen nach: a b Eintrag zu Inosinic acid in der PubChem-Datenbank der United States National Library of Medicine (NLM)
 797
797
- ↑ Hochspringen nach: a b Eintrag zu Inosin-5′-monophosphat. In: Römpp Online. Georg Thieme Verlag.
- ↑ D'Eustachio / reactome:
 5'-phosphoribosyl-5-aminoimidazole-4-carboxamide (AICAR) +
10-formyltetrahydrofolate ⇒ 5'-phosphoribosyl-5-formaminoimidazole-4-carboxamide (FAICAR) + tetrahydrofolate.
5'-phosphoribosyl-5-aminoimidazole-4-carboxamide (AICAR) +
10-formyltetrahydrofolate ⇒ 5'-phosphoribosyl-5-formaminoimidazole-4-carboxamide (FAICAR) + tetrahydrofolate.
- ↑ Jassal / reactome:
 5'-phosphoribosyl-5-formaminoimidazole-4-carboxamide (FAICAR) ⇔
inosine 5'-monophosphate + H2O.
5'-phosphoribosyl-5-formaminoimidazole-4-carboxamide (FAICAR) ⇔
inosine 5'-monophosphate + H2O.
- ↑ reactome:
 adenosine 5'-monophosphate (AMP) + H2O ⇒ inosine 5'-monophosphate (IMP) +
NH4+ (L isoform).
adenosine 5'-monophosphate (AMP) + H2O ⇒ inosine 5'-monophosphate (IMP) +
NH4+ (L isoform).
- ↑ D'Eustachio / reactome:
 inosine 5'-monophosphate (IMP) + NAD+ + H2O ⇒ xanthosine 5'-monophosphate
(XMP) + NADH + H+.
inosine 5'-monophosphate (IMP) + NAD+ + H2O ⇒ xanthosine 5'-monophosphate
(XMP) + NADH + H+.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025