
Molybdän(IV)-sulfid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Molybdän(IV)-sulfid, auch Molybdändisulfid genannt, mit der Formel MoS2, ist ein grauschwarzes, kristallines Sulfid des chemischen Elements Molybdän. Es ist in Wasser und in verdünnten Säuren unlöslich. Neben Molybdändisulfid sind auch noch weitere Molybdänsulfide bekannt.
| Kristallstruktur | ||
|---|---|---|
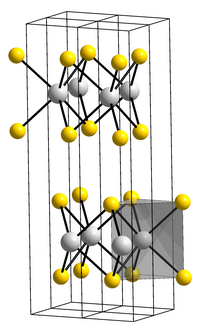
| ||
| _ Mo4+ _ S2− | ||
| Allgemeines | ||
| Name | Molybdän(IV)-sulfid | |
| Andere Namen |
| |
| Verhältnisformel | MoS2 | |
| Kurzbeschreibung | schwarzer, geruchloser Feststoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 215-263-9 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Eigenschaften | ||
| Molare Masse | 160,07 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 5,06 g/cm3 | |
| Schmelzpunkt | 1750 °C | |
| Löslichkeit | in Wasser praktisch unlöslich | |
Vorkommen
In der Natur findet sich Molybdän(IV)-sulfid in Form zweier Minerale, die als Molybdänit (Molybdänglanz) und Jordisit bekannt sind, wobei letzteres zu den wenigen amorphen Mineralen gehört.[2]
Gewinnung und Darstellung
Molybdän(IV)-sulfid kann durch Reaktion von Molybdän(IV)-oxid mit Schwefel unter Anwesenheit von Kaliumcarbonat gewonnen werden.[3]
Ebenfalls möglich ist die Darstellung aus den Elementen.[3]
Eigenschaften

Struktur und physikalische Eigenschaften
Die Struktur von Molybdän(IV)-sulfid ist graphitartig, d.h. es besteht aus raumparallelen Schichten. Wie bei Graphit sind die Atome innerhalb einer Schicht in regelmäßigen Sechsecken angeordnet. Allerdings befinden sich an den Ecken der Sechsecke abwechselnd ein Molybdänatom und ein Schwefelatompaar, wobei je ein Schwefelatom über bzw. unter der Molybdänebene liegt. Von der Seite gesehen enthält jede Kristallschicht eine Molybdänlage, die ähnlich einem Sandwich zwischen zwei Schwefellagen liegt. Aufgrund der raumparallelen Anordnung sind die Kristallschichten leicht gegeneinander verschiebbar, was zu einem schmierenden Effekt führt. Die Schichtstruktur erlaubt es, quasi zweidimensionale Kristalle (ähnlich denen des Graphens) herzustellen.[4] Wie Graphit ist hexagonales Molybdän(IV)-sulfid ein Halbleiter und diamagnetisch.[5] Seine Bandabstandsenergie beträgt 1,2 eV, bei atomar dünnen Schichten (Monolagen) erhöht sich dieser Wert auf 1,8 eV.[6][7][8] Die Verbindung liegt in einer von zwei Modifikationen (2H und 3R) oder einer Mischung aus beiden vor, wobei die 2H-Form dominant ist.[9] Die Kristallstruktur der 2H-Form ist hexagonal mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) und zwei Formeleinheiten pro Elementarzelle.[10] Die 3R-Form besitzt die Raumgruppe R3m (Raumgruppen-Nr. 160).[11] Molybdän(IV)-sulfid ist ein Elektronenleiter, dessen Leitfähigkeit bei Belichtung zunimmt.[3] Molybdändisulfid ist in Wasser und verdünnten Säuren nicht löslich.
Chemische Eigenschaften
Molybdän(IV)-sulfid ist in Luft stabil; es wird aber oberhalb von 315 °C durch den Luftsauerstoff zu Molybdäntrioxid oxidiert:
.
Unter Luftabschluss ist MoS2 bis etwa 930 °C stabil, wobei in der Literatur unterschiedliche Werte angegeben werden.[12] Der in der Literatur häufig angegebene Wert für die Schmelztemperatur von 1185 °C ist falsch, worauf 1959 schon Peter Cannon hinwies.[13] Er ermittelte eine Schmelztemperatur von mindestens 1800 °C und schätzte eine Schmelztemperatur von 2375 °C ab, falls sich Molybdän(IV)-sulfid nach der Tammann-Regel für Sintertemperaturen verhält.[14] Neuere Untersuchungen gehen von einem Schmelzpunkt von etwa 1600 °C unter Helium bei 1 bar für massives Molybdän(IV)-sulfid aus. Dabei hängt der tatsächliche Wert von der Bedingungen ab (z.B. Erhitzungsgeschwindigkeit, vorliegende Kristallform, …) und ist wegen der schon vorher beginnenden Zersetzung nicht einfach zu bestimmen. Für einlagige Molybdän(IV)-sulfid-Schichten geht man von einer Schmelztemperatur von 3700 K durch Dimerisation und weitere Bildung kleiner Polymere aus.[15]
Molybdän(IV)-sulfid löst sich unter Zersetzung in Königswasser; Schwefelsäure zersetzt es zu Molybdän(IV)-oxid. Durch Chlor wird es zum Molybdänpentachlorid oxidiert:[16]
.
Durch Wasserstoff wird es bei etwa 1100 °C zum dreiwertigen Sulfid Mo2S3 (Dimolybdäntrisulfid) reduziert. Auch durch Butyllithium erfolgt eine Reduktion zur dreiwertigen Stufe, wobei sich Lithium zwischen die Schwefelschichten des MoS2 schiebt, es bildet sich die Interkalationsverbindung LiMoS2:
.
Verwendung
Anwendungen als Schmiermittel
Fein pulverisiertes Molybdän(IV)-sulfid mit Teilchengrößen zwischen 0,1 und 40 µm ist ein trockenes technisches Schmiermittel.[17] Es wurde in den 1940er Jahren zuerst von der Firma Dow Corning unter dem Handelsnamen „Molykote“ vermarktet, der auch heute noch synonym für Molybdän(IV)-sulfid steht. Bei Dow Corning (heute DuPont[18]) werden jedoch heute auch andere Spezialschmierstoffe so genannt.[19] An der Luft wird es schon ab 85 °C sehr langsam oxidiert, wobei ein Einsatz als Schmierstoff bis etwa 370 °C möglich ist. Unter Ausschluss von Sauerstoff und Wasserdampf ist die Anwendung bis 1300–1400 °C möglich.[20] Bei verhältnismäßig geringem Luftzutritt, wie dies z. B. in der Praxis an Schrauben und Bolzenverbindungen gegeben ist, behält es bis zu 580 °C und darüber seine Schmierwirkung.[21]
- Es wird häufig verschiedenen Schmierölen beigemengt, was zu einer Verbesserung der Gleitfähigkeit führt.[21] Dies führt neben einer längeren Lebensdauer von Maschinenbauteilen auch zur Schadensvorbeugung bei plötzlichen totalen Ölverlusten. Dabei kann die Schmierwirkung aufgrund der Haftwirkung des Öls eine Zeit lang aufrechterhalten werden, was z.B. bei Flugzeugtriebwerken, Ultrazentrifugen (z.B. der Firma Beckman Coulter unter der Bezeichnung Spinkote) und sonstigen lange nachlaufenden Triebwerken und Turbinen wichtig ist.[22][23]
- Ebenso finden mit Molybdän(IV)-sulfid angereicherte Fette Verwendung an Bauteilen, die schwer zugänglich sind, sodass die Wartungsintervalle sehr groß werden (wartungsfreie Verbindungen, Gelenkkonstruktionen etc.).[23]
- Auch wird es bei der Massivumformung und generell bei Umformverfahren (Kalt-, Halbwarm- und Warmumformung) eingesetzt.[24] Es wird oft beim Bondern aufgebracht. Dies geschieht meistens mit einer Trägerschicht, auf der dann das Molybdän(IV)-sulfid aufgebracht wird.[25] Oft passiert das auch durch „Trommeln“. Dabei kommen die Teile in eine Art Waschmaschinentrommel und tauchen in das Bad ein, die Trommel verbleibt einige Zeit im Medium und dreht sich dabei. Die Teile drehen sich mit und benetzen sich mit Molybdän(IV)-sulfid.[26] Der Vorteil in der Massivumformung gegenüber normaler Seife ist die höhere Temperaturbeständigkeit des Festschmierstoffes. Ebenfalls zum Einsatz kommt es bei hohen Umformtemperaturen ≥ 200 °C (vor allem bei der Kaltmassivumformung), bedingt durch sehr hohe Umformung und somit hoher Reibung im Werkzeug.[23]
- Es wird als schmierender Zusatz in speziellen Kunststoffen verwendet, vornehmlich bei Nylon oder Polyamide.[27]
- Molybdän(IV)-sulfid wird zur Beschichtung von Geschossen von Feuerwaffen kleineren Kalibers verwendet.[28] Die Beschichtung führt zu einer geringeren Reibung zwischen Geschossmantel und Lauf. Hierdurch wird zum einen die Verschmutzung des Laufs durch Blei- oder Tombakreste verringert, zum anderen die Geschossgeschwindigkeit erhöht und in Summe die ballistischen Eigenschaften verbessert.[29]
- Am Oak Ridge National Laboratory wurden selbstschmierende zusammengesetzte Schichten für Hochtemperaturanwendungen entwickelt. Dabei wird durch Kondensation des chemischen Dampfes von Molybdän(IV)-sulfid und Titannitrid eine Schmierschicht auf der Bauteiloberfläche erzeugt.[30]
Sonstige Anwendungen
- Molybdän(IV)-sulfid wird als Katalysator verwendet, z.B. in der Petrochemie als Hilfsmittel bei der Entschwefelung. Nanostruktiertes MoS2 soll als Ersatz für Platinkatalysatoren in Brennstoffzellen verwendet werden; auch bei der Wasserelektrolyse könnte es als Katalysator verwendet werden.[31]
- Die kanadische Firma Moli Energy Limited stellte in den 1980er Jahren wiederaufladbare Zellen und Batterien mit MoS2 als Lithiumspeichermaterial her.[32][33][34] Sie lieferten eine Spannung unter 2 V. Nachdem sie aufgrund ihrer Lithiummetallanode wegen Sicherheitsbedenken 1989 vom Markt genommen worden waren, was zum Bankrott von Moli Energy führte, wurden sie von den heutigen Lithium-Ionen-Akkumulatoren abgelöst, die Spannungen von 3,5–4 V halten.
- Wissenschaftlern vom Berkeley National Laboratory gelang die Herstellung eines Transistors mittels Molybdän(IV)-sulfid, bestehend aus Nickelelektroden, sowie Nanoröhrchen aus Kohlenstoff als Steuerelektrode. Dies könnte künftig zur Herstellung von Transistoren unterhalb der bisher für Silizium-Transistoren kleinstmöglichen Größe von fünf Nanometern führen.[35] Untersuchungen des IMEC zeigen, dass MoS2 als 2D-Material die extreme Skalierung der Strukturen von Integrierten Schaltungen ermöglichen könnte.
Einzelnachweise
- ↑ ↑ Eintrag zu
 Molybdän(IV)-sulfid in der GESTIS-Stoffdatenbank des IFA. (JavaScript erforderlich)
Molybdän(IV)-sulfid in der GESTIS-Stoffdatenbank des IFA. (JavaScript erforderlich) - ↑ Jordisite. In: John W. Anthony, Richard A. Bideaux, Kenneth W. Bladh, Monte C. Nichols (Hrsg.):
Handbook of Mineralogy, Mineralogical Society of America. 2001 (
 PDF 59,7 kB).
PDF 59,7 kB). - ↑ Hochspringen nach: a b c Georg Brauer: Handbuch der präparativen anorganischen Chemie. 3., umgearb. Auflage. Band 3. Enke, Stuttgart 1981, ISBN 3-432-87823-0, S. 1551.
- ↑ Changgu Lee u.a.: Frictional Characteristics of Atomically Thin Sheets.
In: Science. Band 328,
Nr. 5974, 4. Februar 2010,
S. 76–80,
doi:
 10.1126/science.1184167.
10.1126/science.1184167.
- ↑ Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie, Spektrum Akademischer Verlag, Heidelberg, 2001.
- ↑ B. Radisavljevic, A. Radenovic, J. Brivio, V. Giacometti & A. Kis: Single-layer MoS2 transistors. In: Nature Nanotechnology. Nr. 6, 2011, S. 147–150.
- ↑ K. K. Kam, B. A. Parkinson: Detailed Photocurrent Spectroscopy of the
Semiconducting Group VI Transition Metal Dichaicogenides. In: The Journal of Physical Chemistry.
Band 86,
Nr. 4, 1. Februar 1982,
S. 463–467,
doi:
 10.1021/j100393a010.
10.1021/j100393a010. - ↑ Kin Fai Mak, Changgu Lee, James Hone, Jie Shan, Tony F. Heinz:
Atomically Thin MoS2: A New Direct-Gap Semiconductor. In:
Physical Review Letters. Band 105,
Nr. 13, 24. September 2010,
S. 136805,
doi:
 10.1103/PhysRevLett.105.136805.
10.1103/PhysRevLett.105.136805. - ↑ B. Schönfeld, J. J. Huang, S. C. Moss:
Anisotropic mean-square displacements (MSD) in single-crystals of 2H- and 3R-MoS2. In: Acta Crystallographica Section B Structural Science. 39, 1983, S. 404,
 doi:10.1107/S0108768183002645.
doi:10.1107/S0108768183002645.
- ↑ Roger Blachnik (Hrsg.): Taschenbuch für Chemiker und Physiker. Begründet von Jean d’Ans, Ellen Lax. 4., neubearbeitete und revidierte Auflage. Band 3: Elemente, anorganische Verbindungen und Materialien, Minerale. Springer, Berlin 1998, ISBN 3-540-60035-3, S. 580.
- ↑ Shanmin Wang, Jianzhong Zhang, Duanwei He, Y. i. Zhang,
Liping Wang, Hongwu Xu, Xiaodong Wen, Hui Ge, Yusheng Zhao:
 Sulfur-catalyzed phase transition in MoS2 under high pressure and temperature. In: Journal of Physics and Chemistry of Solids. 75, 2014, S. 100,
Sulfur-catalyzed phase transition in MoS2 under high pressure and temperature. In: Journal of Physics and Chemistry of Solids. 75, 2014, S. 100,
 doi:10.1016/j.jpcs.2013.09.001.
doi:10.1016/j.jpcs.2013.09.001.
- ↑
 The Thermal Stability and Friction of the Disulfides, Diselenides,
and Ditellurides of Molybdenum and Tungsten in Vacuum (10-9 To 10-6 Torr) by William A. Brainard Lewis Research Center Cleveland, Ohio, NASA April 1969
The Thermal Stability and Friction of the Disulfides, Diselenides,
and Ditellurides of Molybdenum and Tungsten in Vacuum (10-9 To 10-6 Torr) by William A. Brainard Lewis Research Center Cleveland, Ohio, NASA April 1969
- ↑ PETER CANNON: Melting Point and Sublimation of Molybdenum
Disulphide. In: Nature. 183, 1959, S. 1612,
 doi:10.1038/1831612a0.
doi:10.1038/1831612a0.
- ↑ T.J. Wieting, M. Schlüter: Electrons and Phonons in Layered Crystal Structures. Springer Science & Business Media, 2012, ISBN 978-94-009-9370-9.
- ↑ Sandeep Kumar Singh, M. Neek-Amal, S. Costamagna,
F. M. Peeters: Rippling, buckling, and melting of single- and multilayer MoS2. In: Physical Review B. 91, 2015,
 doi:10.1103/PhysRevB.91.014101.
doi:10.1103/PhysRevB.91.014101.
- ↑ Hermann Sicius: Chromgruppe: Elemente der sechsten Nebengruppe: Eine Reise durch das Periodensystem. Springer-Verlag, 2016, ISBN 978-3-658-13543-0, S. 27.
- ↑ Peter Elsner, Peter Eyerer, Thomas Hirth: DOMININGHAUS - Kunststoffe: Eigenschaften und Anwendungen. Springer-Verlag, 2013, ISBN 978-3-642-16173-5, S. 547.
- ↑
 The Confusing Dow Corning Rebranding: A History of Name Changes. In: pilotshq.com.
Pilots HQ LLC., (englisch).
The Confusing Dow Corning Rebranding: A History of Name Changes. In: pilotshq.com.
Pilots HQ LLC., (englisch).
- ↑
 Über MOLYKOTE® – DuPont. In: dupont.de. (deutsch).
Über MOLYKOTE® – DuPont. In: dupont.de. (deutsch). - ↑ W. O. Winer: Molybdenum disulfide as a lubricant: A review of the fundamental
knowledge. In: Wear. Band 10,
Nr. 6, 1967,
S. 422–452,
doi:
 10.1016/0043-1648(67)90187-1.
10.1016/0043-1648(67)90187-1.
- ↑ Hochspringen nach: a
b F. Weiss: Schmierung und Oberflächenbehandlung mit reinstem Molybdändisulfid. In:
Materials and Corrosion. Band 6,
Nr. 5, 1955,
S. 250–252,
doi:
 10.1002/maco.19550060509.
10.1002/maco.19550060509.
- ↑ A.R. Lansdown: Molybdenum Disulphide Lubrication. Elsevier Science, 1999, ISBN 978-0-08-053692-7, S. 261.
- ↑ Hochspringen nach: a b c Hans-Jürgen Blanke: Expert Praxislexikon Tribologie Plus: 2010 Begriffe für Studium und Beruf. expert verlag, 2000, ISBN 978-3-8169-0691-9, S. 517.
- ↑ Wilfried J. Bartz: Tribologie und Schmierung bei der Massivumformung. expert verlag, 2004, ISBN 978-3-8169-2161-5, S. 261.
- ↑ Patrick-Marcel Mattfeld: Tribologie der zinkphosphatfreien Kaltmassivumformung. Apprimus Wissenschaftsverlag, 2014, ISBN 978-3-86359-218-9, S. 19.
- ↑ Kurt Lange, Mathias Liewald: Umformtechnik Handbuch für Industrie und Wissenschaft: Band 2: Massivumformung. Springer-Verlag, 2013, ISBN 978-3-662-10688-4, S. 668.
- ↑ Serope Kalpakjian, Steven R. Schmid, Ewald Werner: Werkstofftechnik. Pearson Deutschland, 2011, ISBN 978-3-86894-006-0, S. 259.
- ↑ Defense Documentation Center (U.S.): Lubricants and Lubrication. 1963,
S. 181
(
 books.google.com).
books.google.com). - ↑ Patent
 US6090756A:
Ballistics conditioning with molybdenum disulfide. Angemeldet am 26. Juni 1998, veröffentlicht am
18. Juli 2000, Erfinder: David Thomas Brown.
US6090756A:
Ballistics conditioning with molybdenum disulfide. Angemeldet am 26. Juni 1998, veröffentlicht am
18. Juli 2000, Erfinder: David Thomas Brown.
- ↑
 Friction and Wear of Self-Lubricating TiN-MoS Coatings Produced by Chemical Vapor Deposition.
In: astm.org.
Friction and Wear of Self-Lubricating TiN-MoS Coatings Produced by Chemical Vapor Deposition.
In: astm.org.
- ↑ Daniel Merki, Stéphane Fierro, Heron Vrubel, Xile Hu:
Amorphous molybdenum sulfide films as catalysts for electrochemical hydrogen production in water. In:
Chemical Science. Band 2,
Nr. 7, 2011,
S. 1262–1267,
doi:
 10.1039/C1SC00117E.
10.1039/C1SC00117E.
- ↑ Patent
 US4224390:
Lithium molybdenum disulphide battery cathode. Angemeldet am 30. August 1979, veröffentlicht am
23. September 1980, Erfinder: Rudolph R. Haering, James A. R. Stiles, Klaus Brandt.
US4224390:
Lithium molybdenum disulphide battery cathode. Angemeldet am 30. August 1979, veröffentlicht am
23. September 1980, Erfinder: Rudolph R. Haering, James A. R. Stiles, Klaus Brandt.
- ↑ Fred C. Laman, J.A.R. Stiles, R.J. Shank, Klaus Brandt:
Rate limiting mechanisms in lithium-molybdenum disulfide batteries. In:
Journal of Power Sources. Band 14,
Nr. 1–3 (Januar–März), 1985,
S. 201–207,
doi:
 10.1016/0378-7753(85)88031-9.
10.1016/0378-7753(85)88031-9.
- ↑ Klaus Brandt, Fred C. Laman: Reproducibility and reliability of rechargeable
lithium/molybdenum disulfide batteries. In: Journal of Power Sources.
Band 25,
Nr. 4, April 1989,
S. 265–276,
doi:
 10.1016/0378-7753(89)85014-1.
10.1016/0378-7753(89)85014-1.
- ↑ F.A.Z.:
 Die Transistoren schrumpfen weiter.
In: FAZ.net. 23. Oktober 2016.
Die Transistoren schrumpfen weiter.
In: FAZ.net. 23. Oktober 2016.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 05.05. 2024