Zinksulfat
| Sicherheitshinweise | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
Zinksulfat (ZnSO4) ist das Zinksalz der Schwefelsäure (Trivialnamen: schwefelsaures Zinkoxid, weißer Vitriol, (Weißer) Kupferrauch, weißer Galitzenstein, Augenstein, als Mineral: Goslarit). Es bildet farblose Kristalle, in wasserfreier Form ist es ein weißes Pulver.
| Strukturformel | |
|---|---|
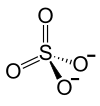 | |
| Allgemeines | |
| Name | Zinksulfat |
| Andere Namen |
|
| Summenformel |
|
| CAS-Nummer |
|
| PubChem | 24424 |
| ECHA-InfoCard | 100.028.904 |
| ATC-Code | A12CB01 |
| Kurzbeschreibung | farblose, rhomboedrische Kristalle |
| Eigenschaften | |
| Molare Masse |
|
| Aggregatzustand | fest |
| Dichte |
|
| Schmelzpunkt | 100 °C (Heptahydrat) |
| Siedepunkt | 680 °C (Zersetzung |
| Löslichkeit | leicht in Wasser (Monohydrat: 350 g/l bei 20 °C; Heptahydrat: 965 g/l bei 20 °C) |
Gewinnung und Darstellung
Zinksulfat wird hergestellt durch Auflösen von Zink oder Zinkoxid in verdünnter Schwefelsäure:
Man kann es auch durch Einwirkung von Zink auf die meisten Schwermetallsulfate gewinnen, wobei das Schwermetall in elementarer Form ausfällt. Beispiele hierfür sind:
.
.
Es entsteht durch oxidative Verwitterung von Zinkblende (Zinksulfid, ZnS)
.
Das so entstandene Mineral ZnSO4 · 7 H2O wird als Goslarit bezeichnet.
Eigenschaften

Zinksulfat zersetzt sich bei Temperaturen oberhalb von 680 °C. Oberhalb von 930 °C verbleibt reines Zinkoxid.
Es kristallisiert aus seinen wässrigen Lösungen als Zinkvitriol in farblosen, rhombischen Kristallen mit 7 Molekülen Wasser (ZnSO4 · 7 H2O) (Heptahydrat). Es verliert beim Erhitzen seine Wasseranteile und zerfällt zu einem weißen Pulver. Zinksulfat zeigt in wässriger Lösung infolge teilweiser Hydrolyse eine schwach saure Reaktion. Beim Lösen des wasserfreien Salzes in Wasser tritt Erwärmung ein, beim Lösen von ZnSO4 · 7 H2O dagegen Abkühlung.
Es verwittert oberflächlich an der Luft durch Verlust von Kristallwasser und schmilzt beim Erwärmen in seinem Kristallwasser. Es verliert schon bei 39 °C ein Molekül Kristallwasser; bei 70 °C liegt nur noch ein Wassermolekül vor, das bei 240 °C abgespalten wird.
Verwendung
Zinksulfat wird in der Färberei, zur Holzimprägnierung und zur Herstellung von Elektrolysezink verwendet. Auf Grund der bakterientötenden Wirkung von Zn2+-Ionen werden sehr verdünnte Lösungen von ZnSO4 (0,1–0,5 %) als Augenwasser bei Bindehautentzündungen eingesetzt.
Man benutzt Zinksulfat ferner:
- in der Kattundruckerei
- zum Konservieren von Holz und Häuten
- als Flammschutzmittel
- als Zusatz zu Firnis, um das Öl schnell trocknend zu machen
- bei der Feuerversilberung
- als Wirkstoff gegen Herpes labialis
- als bakteriziden Wirkstoff in Zahnpasta
Es dient weiterhin als Brechmittel, Beize in der Textilindustrie, Spurennährstoff in Düngemitteln und ist in Fällungsbädern bei der Kunstseidegewinnung enthalten. Zinksulfat wird auch zur Herstellung von Zinksulfid-Pigmenten und anderen Zinkverbindungen, zur Flotation von Erzen, Beschweren von Baumwolle und in galvanischen Verzinkungsbädern verwendet.
Nachweis
Natronlauge (NaOH) gibt mit Zinksulfat einen gallertartigen Niederschlag von Zinkhydroxid, der nach Befeuchten mit einer verdünnten Cobaltsalzlösung und Glühen das sogenannte Rinmans Grün ergibt.
Bariumchloridlösung bildet einen weißen Niederschlag von Bariumsulfat:
- Zinksulfat und Bariumchlorid reagieren zu Zinkchlorid und Bariumsulfat, das ausfällt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.05. 2025




