Zinkchlorid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | Schweiz: 1 mg/m3 (gemessen als alveolengängiger Staub) | ||||||||
| Toxikologische Daten | 350 mg/kg (LD50, Ratte, oral) | ||||||||
Zinkchlorid (ZnCl2) ist ein weißes, körniges Pulver, das beim Erhitzen von Zink in Chlor oder von Zinksulfat mit Calciumchlorid, auch bei der Reaktion von Zink, Zinkoxid oder Zinkblende mit Salzsäure entsteht.
| Kristallstruktur | ||
|---|---|---|
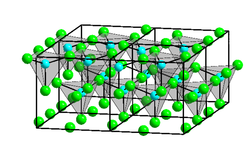
| ||
| Struktur von α-Zinkchlorid: _ Zn2+ _ Cl− | ||
| Allgemeines | ||
| Name | Zinkchlorid | |
| Andere Namen |
| |
| Verhältnisformel | ZnCl2 | |
| Kurzbeschreibung | weißes, körniges Pulver aus hexagonal-rhomboedrischen Blättchen | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 231-592-0 | |
| ECHA-InfoCard | ||
| PubChem | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 136,29 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 2,91 g/cm3 (25 °C) | |
| Schmelzpunkt | 290 °C | |
| Siedepunkt | 732 °C | |
| Löslichkeit | ||
Geschichte
Zinkchlorid wurde 1648 von Johann Rudolph Glauber aus Galmei und 1741 von Johann Heinrich Pott aus Zink dargestellt.
Gewinnung und Darstellung
Zur Darstellung von reinem Zinkchlorid setzt man Zink mit Salzsäure um, wobei das Metall zuletzt im Überschuss vorhanden sein muss, behandelt die Lösung mit Chlor, um Verunreinigungen von Eisen in Eisen(III)-chlorid (FeCl3) umzuwandeln, fällt dann das Eisenhydroxid durch Digerieren mit Zinkoxid, filtriert und verdampft, bis ein Tropfen auf einer kalten Porzellanplatte erstarrt.
Bei stärkerem Verdampfen entweicht Salzsäure, und das Präparat gibt dann infolge der Bildung von basischen Zinkchloriden, komplizierter Zusammensetzungen, eine trübe Lösung. Verdampft man zur Trockne, so erhält man bei stärkerem Erhitzen ein Sublimat von wasserfreiem Zinkchlorid.
Im großen Maßstab erhält man Zinkchlorid durch Umsetzung zinkischer Ofenbrüche (Zinkoxid) mit Salzsäure, durch Behandeln von Zinkblende mit Salzsäure, wobei das entweichende Schwefelwasserstoffgas (H2S) für die Schwefelsäurefabrikation verwertet wird, ferner durch Auslaugen gerösteten blendehaltigen Schwefelkieses.
Eigenschaften
Wasserfreies Zinkchlorid ist weißlich, durchscheinend (Zinkbutter), schmilzt bei über 318 °C, destilliert bei Rotglut, ist sehr hygroskopisch und sehr leicht löslich in Ethanol. Die Lösung wird beim Verdampfen sirupartig und liefert, mit etwas Salzsäure versetzt, farblose, sehr zerfließliche Kristalle mit einem Molekül Wasser.
Zinkchlorid schmeckt brennend, wirkt stark ätzend, löst Pflanzenfasern, entzieht vielen organischen Stoffen – in der Weise wie konzentrierte Schwefelsäure – Wasser, verkohlt beispielsweise Holz, führt zur Umwandlung von Alkohol in Ether (Äther), Papier in Pergamentpapier etc.
Verwendung
Man benutzt Zinkchlorid zum Imprägnieren von Holz, zur Konservierung tierischer Stoffe, beim Raffinieren von Öl, bei der Herstellung von Pergamentpapier, Vulkanfiber, Ether, Stearinsäure; mit Chlorkalk zum Bleichen von Papier, in der Färberei als Beize für Anilinblau, zur Darstellung mancher Teerfarben und von Garancins, zum Beizen und Färben von Messinglegierungen, zum Leimen von Papiermassen, zum Desinfizieren, bei chemischen Arbeiten als wasserentziehendes Mittel, in der Medizin als Ätzmittel, eine konzentrierte Lösung zum gleichmäßigen Erhitzen von Gefäßen auf eine bestimmte höhere Temperatur.
Eine Lösung von sirupartigem Zinkchlorid, mit Zinkoxid angerührt, erstarrt und gibt eine aus basischem Zinkchlorid bestehende weiße, sehr harte Masse, die als Zahn- und Metallkitt benutzt werden kann, besonders wenn man etwas Glaspulver zusetzt. Auch Anstriche, in denen sich Zinkoxidchlorid bildet, sind empfohlen worden.

Man mischt beispielsweise 4 l säurefreie Zinkchloridlösung von 58 °Bé (entsprechend einer Dichte von 1,74 g/cm3) mit 10 l einer Lösung, welche 2 % Natriumcarbonat enthält, und setzt Zinkoxid bis zur gehörigen Konsistenz hinzu. Diese geruchlose und billige Mischung muss sofort verbraucht werden. Der Anstrich ist dauerhaft, verträgt aber keine färbenden Zusätze. Eine Lösung von Zinkchlorid vom spezifischen Gewicht 1,7, mit überschüssigem Zinkoxid gekocht, löst Seide.
Lötwasser und Lötsalz
Aus gemischten, sehr konzentrierten Lösungen von Zinkchlorid und Salmiak oder aus einer Lösung von Zinkoxid oder Zinkhydroxid in Salmiak kristallisiert Ammoniumzinkchlorid (NH4)2[ZnCl4] (Lötsalz). Eine Lösung von Zink in konzentrierter Salzsäure, welche ebenso viel Salmiak wie Zink enthält (Lötwasser), beseitigt die Oxide von einem Metallstück (Kupfer, Eisen), ehe es verlötet oder verzinnt wird.
Man kann alternativ aber auch eine mit etwas Salzsäure angesäuerte etwa 30%ige Lösung von Zinkchlorid in Wasser unter Zusatz von wenig Ammoniumchlorid als Lötwasser verwenden. Es wird in der Technik als Benetzungs- und Oberflächenaktivierungsmittel zur Verzinnung bei etwa 300 °C eingesetzt. Das Zinkchlorid ist in der Lage, besonders in der Hitze die auf den Oberflächen z.B. von Stahl sich befindenden Oxide (Fe2O3) durch Komplexbildung aufzulösen, von der Stahloberfläche abzuführen und nach Verzinnung einen unmittelbaren Kontakt zwischen Stahl und Zinn zu ermöglichen: Es entsteht eine feste Bindung zwischen Stahl und Zinn.
In Nebel- oder Rauchsätzen wird Zinkchlorid in fein verteilter Form erzeugt durch die Verbrennung einer Mischung aus Zinkoxid, Hexachlorethan und pulverförmigem Aluminium. Neben Zinkchlorid enthält der so erzeugte Rauch auch Salzsäure und weitere chlororganische Verbindungen.
Missbräuchliche Verwendung als „Schwarze Salbe“
In der Alternativmedizin wird eine nicht zugelassene, in Deutschland und den USA verbotene „Schwarze Salbe“ als Mittel gegen Krebs, Warzen, Muttermale oder als Antiphlogistikum beworben. Sie enthält neben Zinkchlorid weitere Bestandteile wie Kanadische Blutwurz, Spitzwegerich, Calendulaöl und Aktivkohle. Es existieren keine Belege zur Wirksamkeit, die Salbe ist ätzend, verursacht bei wiederholter Anwendung schwere Hautverletzungen bzw. Nekrosen und ist selbst krebserregend.
Nachweis
Natronlauge (NaOH) ergibt mit Zinkchlorid einen gallertartigen Niederschlag von Zinkhydroxid Zn(OH)2, der sich im Überschuss des Fällungsmittels unter Bildung des tetraedischen, komplexen Tetrahydroxidozinkats(II) [Zn(OH)4]2− wieder löst. Mit Ammoniaklösung anstatt Natronlauge löst sich das zunächst entstehende Hydroxid zum Tetramminkomplex.
Wird Silbernitrat zu einer Lösung von Zinkchlorid gegeben, so bildet sich ein weißer Niederschlag von Silberchlorid:
Aus einer salzsauren, acetatgepufferten Lösung fällt das Zink mit Kaliumhexacyanidoferrat(II) als schwerlöslicher, weißlicher Niederschlag aus:
Zink kann auch als Rinmans Grün nachgewiesen werden.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.05. 2025


