
Glycolsäure
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| Toxikologische Daten | ||||||||
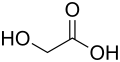
Glycolsäure (Hydroxyessigsäure) ist die einfachste α-Hydroxycarbonsäure mit der Formel HOCH2–COOH. Die Hydroxymethylgruppe lässt sich wie bei anderen primären Alkoholen über den Aldehyd (Glyoxylsäure) zur Carboxygruppe (Oxalsäure) oxidieren.
Vorkommen
| Strukturformel | |
|---|---|
| |
| Allgemeines | |
| Name | Glycolsäure |
| Andere Namen | |
| Summenformel | C2H4O3 |
| Kurzbeschreibung | farb- und geruchloser, hygroskopischer Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 79-14-1 |
| ECHA-InfoCard | 100.001.073 |
| PubChem | 757 |
| ChemSpider | 737 |
| DrugBank | DB03085 |
| Eigenschaften | |
| Molare Masse | 76,05 g/mol−1 |
| Aggregatzustand | fest |
| Dichte | 1,49 g/cm3 |
| Schmelzpunkt | 76–80 °C |
| Siedepunkt | 100 °C (Zersetzung) |
| Dampfdruck | 10,8 hPa (80 °C) |
| pKS-Wert | 3,83 |
| Löslichkeit | sehr gut in Wasser |

Glycolsäure findet sich in unreifen Weintrauben, in Zuckerrohrsaft, in Zuckerrüben, in den Blättern des wilden Weins und im Rosmarin. Als Oxidationsprodukt ist sie auch in Eisessig enthalten. Auf Grund ihres natürlichen Vorkommens wird die Glycolsäure zu den Fruchtsäuren gezählt.
Herstellung
Großtechnisch wird Glycolsäure durch alkalische Hydrolyse von Chloressigsäure synthetisiert:
Auch die Synthese aus Kohlenstoffmonoxid, Wasser und Formaldehyd ist möglich:
- Aus Formaldehyd, Wasser und Kohlenstoffmonoxid entsteht Glycolsäure
Verwendung
Glycolsäure wird als 20%ige wässrige Lösung zur Entrostung von Rohrleitungen durch Chelatisierung von Calcium- und Eisen-Ionen eingesetzt. In der Textilindustrie wird die Säure zur Haltbarmachung („Avivierung“) und als Katalysator, in der Lederindustrie zum Entkalken von Tierhäuten, zur Chromgerbung und zum Färben eingesetzt. Auch bei der Synthese (als milde organische Säure) sowie als Ausgangsprodukt für verschiedene Ester findet Glycolsäure Verwendung.
Daneben wird die Fruchtsäure Glycolsäure zur Hautpflege eingesetzt. Hier erfüllt sie eine Peeling-Funktion und verbessert so das Hauterscheinungsbild.
Sicherheitshinweise
Die brennbare Glycolsäure wirkt in reiner Form ätzend auf Augen, Haut, Schleimhäute und Atemwege. Im Tierexperiment mit Ratten, Meerschweinchen und Katzen erwies sie sich als nur gering toxisch. Dabei zeigte sie Auswirkungen auf das Geruchsvermögen, Atemstörungen, Schläfrigkeit und Veränderungen in Magen- und Nierengewebe.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.11. 2024

