
Anthracen
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| Zulassungsverfahren unter REACH | besonders besorgniserregend: persistent, bioakkumulativ und toxisch (PBT) | |||||||

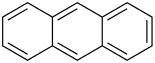
Anthracen [antraˈt͡seːn] (von griech. anthrax, ‚Kohle‘), auch Paranaphthalin oder veraltet Anthrazen ist ein farbloser kristalliner Feststoff, der leicht sublimiert. Es ist ein polycyclischer aromatischer Kohlenwasserstoff und organischer Halbleiter mit der Summenformel C14H10, der nach dem Bauprinzip der Acene aus drei anellierten Benzolringen aufgebaut ist.

Geschichte
Anthracen wurde 1832 zum ersten Mal von Auguste Laurent und Jean-Baptiste Dumas aus dem Teer isoliert. Laurent stellte auch 1836 durch Oxidation des Anthracens Anthrachinon und Phthalsäure zum ersten Mal her.
Vorkommen
Auf der Erde findet sich Anthracen in Steinkohlenteer. Oxidierte Anthracenderivate – meist Anthrachinone – kommen häufig in Organismen vor. Positiv geladene Anthracenmoleküle wurden sowohl in Meteoriten wie auch kürzlich von der Royal Astronomical Society in interstellarer Materie nachgewiesen. Das komplexeste Molekül, das vor dem Anthracen im interstellaren Raum entdeckt wurde, war Naphthalin.
Gewinnung und Darstellung
Anthracen wird industriell aus Steinkohlenteer gewonnen. Die synthetische Herstellung erfolgt durch Pyrolyse von 2-Methylbenzophenon oder durch Friedel-Crafts-Alkylierung von 2-Brombenzylbromid. Alternativ kann es auch durch Reduktion von Anthrachinon hergestellt werden, welches wiederum durch Diels-Alder-Reaktion von p-Benzochinon mit 1,3-Butadien oder durch Friedel-Crafts-Acylierung von Benzol mit Phthalsäureanhydrid in Gegenwart von Aluminiumchlorid zugänglich ist. Letztere war die ursprüngliche Synthese, die 1883 von Richard Anschütz erfunden wurde. Die am häufigsten verwendeten Reduktionsmittel für Anthrachinon sind:
- Zink im alkalischen Milieu,
- amalgamiertes Aluminium in sekundären Alkoholen,
- Zinn(II)-chlorid und HCl in Essigsäure
- Natriumborhydrid
Eigenschaften
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Anthracen |
| Andere Namen |
|
| Summenformel | C14H10 |
| Kurzbeschreibung | weiße bis gelbliche Blättchen mit aromatischem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 120-12-7 |
| EG-Nummer | 204-371-1 |
| ECHA-InfoCard | 100.003.974 |
| PubChem | 8418 |
| Eigenschaften | |
| Molare Masse | 178,24 g/mol |
| Aggregatzustand | fest |
| Dichte | 1,25 g/cm3 |
| Schmelzpunkt | 217 °C |
| Siedepunkt | 340 °C |
| Dampfdruck | 8 mPa (25 °C) |
| Löslichkeit |
|
Anthracen kristallisiert in farblosen bis gelblichen Blättchen, die violett
fluoreszieren
und leicht sublimieren.
Sie schmelzen bei 216,3 °C und sieden bei 340 °C. Anthracen ist in Wasser nahezu
unlöslich (etwa 0,1 mg/l bei 25 °C), wenig löslich in Ethanol (15 g/l) und Diethylether, und gut
löslich in siedendem Benzol.
Anthracen riecht nur sehr schwach aromatisch und ist nahezu geruchlos. Da im
Anthracen nur ein Sechsring ein -Elektronensextett
enthält, ist es ziemlich reaktiv, reaktiver als das Isomer Phenanthren, das im
Gegensatz zum Anthracen zwei Ringe mit einem
-Elektronensextett
aufweist. Vor allem die Positionen 9 und 10 stellen hier ideale Angriffspunkte
z. B. für Oxidationen dar, durch welche Anthracen beispielsweise in
Anthrachinon umgewandelt
werden kann. Anthracen dimerisiert
durch UV-Licht-Einfluss;
das Dimer zerfällt aber schon durch Wärmeeinwirkung wieder.
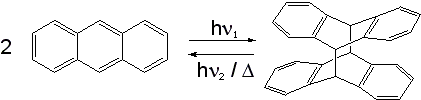
Da es bei Anthracen nach dem Inkrementsystem zwei unterschiedliche mesomere Grenzstrukturen gibt, sind diese bei der Berechnung der Mesomerieenergie zu beachten und der Mittelwert der Bildungsenthalpien zu bilden, bevor man die Differenz zur tatsächlichen Bildungsenthalpie zieht.
Der Flammpunkt liegt bei 121 °C, die Zündtemperatur bei 540 °C. Die untere Explosionsgrenze (UEG) beträgt in Luft 0,6 Vol.-% (45 g/m3). Anthracen ist wassergefährdend (WGK 2). Die Standardbildungsenthalpie beträgt in der Festphase 121 ± 10 kJ·mol−1, in der Gasphase 223 ± 10 kJ·mol−1. Die Standardverbrennungsenthalpie in der Festphase liegt bei −7061 ± 10 kJ·mol−1.
Verwendung
Anthracen wird fast ausschließlich zu Anthrachinon weiterverarbeitet, welches den Ausgangspunkt für die Anthrachinonfarbstoffe darstellt und somit die Grundlage für die Alizarin- und Indanthrenfarbstoffe ist. Eine weitere Verwendung findet das Anthracen als Basisstoff für die Herstellung von Schädlingsbekämpfungsmitteln und Gerbstoffen. Der Anthracen-Abkömmling Dithranol ist der älteste Wirkstoff, der für die Behandlung von Schuppenflechte entwickelt wurde.
Nomenklatur
Nach der IUPAC-Nomenklatur ist für Anthracen eine spezielle Positionsnummerierung der Kohlenstoffatome erklärt, die sich von der (Spezial-)Nummerierung seines Isomers Phenanthren ableitet. Diese Nummerierung wird teilweise auch auf heterocyclische Verbindungen mit derselben Grundstruktur (bei denen lediglich Kohlenstoffatome durch andere Atome ersetzt sind) übertragen. Ein Beispiel ist 4-Azaphenothiazin (Pyridobenzothiazin, Pyrido[3,2-b]benzothiazin) und Derivate davon wie Prothipendyl. Dort fällt dann die übliche dominante Rolle der Hetero-Atome bei der Nummerierung weg.
-
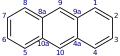 Anthracen mit Spezialnummerierung
Anthracen mit Spezialnummerierung -
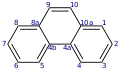 Phenanthren mit Spezialnummerierung
Phenanthren mit Spezialnummerierung
Die Standardnummerierung von Anthracen würde bis zur Position 4 mit der hier gezeigten übereinstimmen, dann aber ohne „Sprünge“ rundum weitergehen. Bei Phenanthren würde hingegen die Standardnummerierung gegensinnig laufen müssen und bei der hier gezeigten Position 4 beginnen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 28.12. 2023

