
Chemisches Potential
Das chemische Potential oder chemische Potenzial
ist eine thermodynamische
Zustandsgröße, die zur Analyse von heterogenen,
thermodynamischen Systemen von Josiah
Willard Gibbs eingeführt wurde. Jeder Stoffkomponente (chemisches Element
oder chemische Verbindung) einer jeden homogenen
Phase eines thermodynamischen
Systems ist ein chemisches Potential zugeordnet. Die Bedingungen für das
thermodynamische Gleichgewicht und die stöchiometrische
Bilanzen bei chemischen Stoffumwandlungen führen auf lineare Gleichungen
zwischen den chemischen Potentialen. Diese Gleichungen ermöglichen die
Bestimmung der verschiedenen Stoffanteile in den einzelnen Phasen (etwa bei der
Destillation), die
Berechnung der Druckdifferenz bei einer Osmose,
die Bestimmung der Gefrierpunktserniedrigung,
die Berechnung der Gleichgewichtskonstanten
von chemischen
Reaktionen und die Analyse der Koexistenz
verschiedener Phasen. Darüber hinaus kann für eine Einwirkung von außen auf
eine Größe wie die Temperatur, den Druck oder einen Stoffmengenanteil mittels
der chemischen Potentiale die spontane Entwicklungsrichtung des Systems zurück
zu einem Gleichgewichtszustand ermittelt werden.
Anschauliche Interpretation
Das chemische Potential einer Komponente gibt die Änderung der inneren Energie eines Systems an, wenn sich die Teilchenzahl dieser Komponente ändert und dabei Volumen und Entropie konstant bleiben. Es beschreibt zum Beispiel die Änderung der inneren Energie pro zugesetzter Stoffmenge einer bestimmten Komponente oder die Änderung der inneren Energie, wenn eine Komponente während einer Reaktion verbraucht wird. Das chemische Potential kann in Analogie zu anderen intensiven Zustandsgrößen wie dem Druck gesehen werden. Der Druck beschreibt die Änderung der inneren Energie, wenn sich das Volumen ändert. Gleich wie der Druck ist das chemische Potential einer Komponente ein Maß für die verrichtete Arbeit; statt mechanischer handelt es sich aber um chemische Arbeit.
Definition
Das chemische Potential beschreibt die Änderung der in einem System
gespeicherten Energie, wenn sich die Teilchenanzahl einer chemischen Spezies im
System verändert. Um dies zu präzisieren muss erst die in einem System
gespeicherte Energie definiert werden. Dies geschieht durch die Änderung der inneren Energie
eines Systems.
Das bedeutet, dass sich die innere Energie ändert, wenn man Wärme hinzufügt
oder abführt ()
oder das System Arbeit verrichtet oder Arbeit an ihm verrichtet wird (
).
Die Art der Arbeit kann dabei mechanischer, elektrischer oder chemischer Natur
sein. Im Folgenden werden nur mechanische und chemische Arbeit betrachtet. Die
mechanische Arbeit kann als
geschrieben werden. Komprimiert man ein System (
),
so verrichtet man Arbeit am System und die gespeicherte Energie wird erhöht. Per
Definition ist eine Erhöhung der gespeicherten Energie als positive Änderung der
inneren Energie definiert. Die Änderung der gespeicherten Wärmeenergie
ist über die Änderung der Entropie
im System definiert wobei
die Temperatur repräsentiert. Es folgt somit:
Die chemischen Potentiale müssen sich nun im Term
wiederfinden, da sie ja die Änderung der inneren Energie bei Verrichtung von
chemischer Arbeit charakterisieren sollen. Da chemische Arbeit mit dem Ablaufen
von chemischen Reaktionen verbunden ist, sei nun eine chemische Reaktion
formuliert.
Die Stoffe A und B werden dabei zu den Stoffen C und D umgesetzt, wobei
chemische Arbeit verrichtet wird. Wenn die Reaktion freiwillig abläuft,
erniedrigt sich die innere Energie des Systems, wohingegen die innere Energie
des Systems erhöht wird, wenn die Reaktion erzwungen werden muss. Im ersten Fall
verrichtet das System chemische Arbeit, im zweiten Fall wird chemische Arbeit an
ihm verrichtet. Jedenfalls ändert sich die Teilchenanzahl jedes Stoffs im System
beim Fortschreiten der Reaktion. Meist ist es gebräuchlich anstatt der Änderung
der Teilchenanzahl ,
die Änderung der Stoffmenge zu
zu verwenden, wobei der Subskript
den betrachteten Stoff bezeichnet. Da nun das chemische Potential die Änderung
der inneren Energie pro umgesetzter Stoffmenge charakterisieren soll, ergibt
sich für die chemische Arbeit:
Wenn nun
verschiedene Reaktionspartner beteiligt sind, so ergibt sich für die Änderung
der inneren Energie:
Die innere Energie ist somit eine Funktion der Entropie, des Volumens sowie
der Stoffmengen der Komponenten des Systems .
Das chemische Potential einer Komponenten
kann nun als partielle Ableitung der inneren Energie nach seiner Stoffmenge
definiert werden. Die anderen extensiven Zustandsgrößen wie die Entropie, das
Volumen und die Stoffmengen der anderen Komponenten
werden dabei konstant gehalten.
Somit ist gezeigt, dass das chemische Potential als Änderung der inneren Energie pro Änderung der Stoffmenge bzw. Teilchenanzahl definiert ist.
Diese Definition zeigt auch die Unterschiede zu anderen Potentialen, wie zum Beispiel dem elektrischen Potential auf. Bei elektrischen Potential handelt es sich um die Stammfunktion des elektrischen Feldes. Das chemische Potential ist jedoch die Ableitung eines thermodynamischen Potentials. Es ist in diesem Vergleich also analog zu einer Komponente des elektrischen Feldes.
Das chemische Potential eines Stoffs setzt sich aus einem idealen Anteil und einem Wechselwirkungs-Anteil (excess) zusammen:
wobei der ideale Anteil durch das chemische Potential eines idealen Gases gegeben ist. Gelegentlich wird auch die folgende Definition getroffen
wobei
das Standard chemische Potential der Teilchensorte i ist.
Alternative Formulierungen
Alternativ zur inneren Energie lassen sich auch andere thermodynamische
Potentiale definieren, die Auskunft darüber geben ob eine chemische Reaktion
freiwillig abläuft oder nicht. Im Falle der inneren Energie läuft eine chemische
Reaktion freiwillig ab (das System gibt Energie an die Umgebung ab) wenn .
Dasselbe gilt für die Enthalpie,
die freie Energie sowie die
freie
Enthalpie. Diese thermodynamischen Potentiale werden durch sukzessive Legendre-Transformationen
der inneren Energie gewonnen. Während dieser Variablentransformationen bleibt
jedoch die Stoffmenge unberührt. Somit kann das chemische Potential einer
Komponenten
auch als partielle Ableitung der vorher genannten thermodynamischen Potentiale
nach der Stoffmenge der Komponente
definiert werden. Neben den Definitionen des chemischen Potentials der
Komponente
ist auch die Transformationsgleichung für das dementsprechende thermodynamische
Potential gegeben. Beispielsweise wird die Enthalpie direkt aus der inneren
Energie gewonnen. Wie man sieht geht in keine Transformationsgleichung die
Stoffmenge ein, wie vorhin bereits erwähnt wurde. Somit kann das chemische
Potential wie folgt geschrieben werden:
aus der Enthalpie
aus der freien Energie
aus der freien Enthalpie
Chemisches Gleichgewicht
Die chemischen Potentiale der Komponenten, die an einer chemischen Reaktion beteiligt sind, eignen sich auch zur Beschreibung des chemischen Gleichgewichtes. Zuerst sei die Bedingung für chemisches Gleichgewicht mit Hilfe der freien Enthalpie bei konstantem Druck und konstanter Temperatur formuliert:
Eine chemische Reaktion im Gleichgewicht kann wie folgt formuliert werden:
Die oben genannte Gleichgewichtsbedingung kann für diese Reaktion wie folgt formuliert werden:
Jede Änderung der Stoffmenge einer Komponente kann durch die
Stoffmengenänderung einer anderen Komponente beschrieben werden. So kann die
Änderung der Stoffmenge der Komponente A durch
ausgedrückt werden. Das negative Vorzeichen stammt daher, dass die Stoffmenge
der Komponente A abnimmt wenn die Stoffmenge der Komponente D zunimmt.
Führt man dies nun für alle Terme durch so gelangt man zu:
Da die Änderung der Stoffmenge der Komponente D nicht null sein kann, gelangt
man durch Multiplikation mit
zu folgender Gleichgewichtsbedingung:
Dies stellt eine wichtige Erkenntnis dar. Das chemische Gleichgewicht kann somit vollständig durch die chemischen Potentiale der Komponenten sowie durch deren Reaktionskoeffizienten beschrieben werden. Allgemein gilt bei chemischem Gleichgewicht:
Die Einsicht, dass sich das chemische Gleichgewicht mit Hilfe der chemischen Potentiale der Komponenten ausdrücken lässt ermöglicht die Formulierung der Gleichgewichtskonstanten für eine chemische Reaktion. Zuallererst muss dafür die Konzentrationsabhängigkeit des chemischen Potentials erarbeitet werden. Man erinnere sich erst, dass für die Änderung der freien Enthalpie im Gleichgewicht folgende Beziehung gilt:
Integriert man diese Gleichung und bildet anschließend das totale Differential, so gelangt man zu folgendem Ausdruck:
Durch Vergleich mit dem totalen Differential der freien Enthalpie erhält man:
Unter der Annahme konstanter Temperatur vereinfacht sich diese Gleichung weiters zu:
Der Einfachheit halber sei angenommen, bei dem betrachteten System handle es sich um ein ideales Gas, dessen Gesamtdruck sich aus den Partialdrücken der einzelnen Komponenten ergibt. Somit kann die letzte Gleichung nur für eine Komponente geschrieben werden:
Integriert man nun diese Gleichung auf beiden Seiten von Standardbedingungen bis zu einem frei wählbaren Zustand,
so ergibt sich die Abhängigkeit des chemischen Potentials einer Komponente
Der Quotient im Logarithmus-Term kann als Molenbruch des idealen Gases
identifiziert werden. Sollen nun auch nicht ideale Wechselwirkungen wie bei
realen Gasen oder Elektrolytlösungen mitberücksichtigt werden, so ist der
Molenbruch durch die Aktivität
zu ersetzen. Alternativ könnte man weiter oben auch mit einer Gasgleichung
ansetzen die nicht ideales Verhalten berücksichtigt. Jedoch wird das schon im
Falle der Van-der-Waals-Gleichung
für reale Gase sehr kompliziert und man wählt daher die vorgestellte
Herangehensweise. Somit kann man nun das chemische Potential einer Komponente in
Abhängigkeit von der Aktivität
anschreiben:
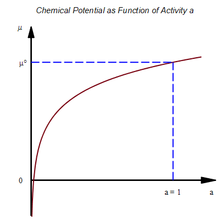
Eingangs wurde bereits die Erkenntnis gewonnen, dass das chemische Gleichgewicht durch die chemischen Potentiale und durch die Koeffizienten in der Reaktionsgleichung der Gleichgewichtsreaktion definiert ist. Setzt man den gewonnenen Ausdruck ein, der die Aktivität einer Komponenten berücksichtigt, so erhält man nach Umformen:
Der Term auf der linken Seite ist die freie Reaktionsenthalpie bei
Standardbedingungen und beinhaltet alle
Terme, die die chemischen Potentiale der Komponenten bei Standardbedingungen
beschreiben. Die freie Reaktionsenthalpie bei Standardbedingungen ist konstant.
Das heißt nun, dass auch der Quotient im Logarithmusterm konstant sein muss. Es
handelt sich dabei um die Gleichgewichtskonstante
im chemischen Massenwirkungsgesetz:
Das chemisches Gleichgewicht ist durch die chemischen Potentiale der Komponenten der Gleichgewichtsreaktion gegeben. Daraus kann das chemische Massenwirkungsgesetz abgeleitet werden.
Neben dem Massenwirkungsgetz lassen sich aus der Konzentrationsabhängigkeit des chemischen Potentials auch die Diffusionsgesetze für gelöste Teilchen sowie der Diffusionskoeffizient ableiten. Eine detaillierte Herleitung ist im Artikel Diffusion zu finden.
Chemisches Potential in der statistischen Thermodynamik
Bisher wurde das chemische Potential im Zusammenhang mit chemischen Reaktionen diskutiert. Das chemische Potential tritt aber auch in Verteilungsfunktionen auf, die die Energieverteilung von Teilchen beschreiben. Dabei handelt es sich um die Fermi-Dirac-Statistik sowie die Bose-Einstein-Statistik. Die Fermi-Dirac Statistik beschreibt die Verteilung von Elektronen auf eine Zustandsdichte in einem Festkörper. Formelmäßig ist die Fermi-Dirac Statistik wie folgt definiert:
,
wobei
die Besetzungswahrscheinlichkeit eines Zustandes in Abhängigkeit von der Energie
ist, während
die Boltzmann-Konstante,
die absolute Temperatur und
das chemische Potential des Elektrons ist (im folgenden Text wird abgekürzt nur
mehr vom chemischen Potential gesprochen). In diesem Fall ist das chemische
Potential die partielle Ableitung der freien
Energie nach der Teilchenanzahl
.
Das chemische Potential charakterisiert dabei den Wendepunkt der Fermi-Verteilung. Die Fermi-Energie ist der Grenzwert des chemischen Potentials für 0 Kelvin. Häufig wird auch für höhere Temperaturen der Begriff Fermi-Energie an Stelle des chemischen Potentials verwendet, da die Temperaturabhängigkeit bei Raumtemperatur nicht sehr stark ausgeprägt ist. Eine physikalische Interpretation des chemischen Potentials ist hierbei analog zu der oben gegebenen. Es charakterisiert die Energie die notwendig ist um ein Elektron aus dem Festkörper zu entfernen. An diesem Beispiel ist auch ersichtlich, dass für diesen Fall das chemische Potential nicht die Einheit Joule/Mol trägt, sondern schlicht Joule. Beides ist zulässig, da die Einheit Mol nur eine definierte Teilchenanzahl darstellt.
In der Bose-Einstein Statistik tritt ebenfalls das chemische Potential auf. Sie dient zur Beschreibung der Besetzungswahrscheinlichkeit von Bosonen, die im Gegensatz zu Elektronen keine Teilchenbeschränkung pro Energiezustand haben.
Zu diesen Teilchen können auch Teilchen wie Phononen oder Photonen gehören, für die keine Teilchenerhaltung notwendig ist wie zum Beispiel für Elektronen in einem Festkörper. Eine Konsequenz davon ist, dass das chemische Potential für diese Teilchen Null ist.
Elektrochemisches Potential
- Hauptartikel Elektrochemisches Potential
Eingangs wurde das chemische Potential mit Hilfe der inneren Energie definiert wobei keine elektrische Arbeit berücksichtigt wurde. Tut man dies so gelangt man zu folgendem Ausdruck für die Änderung der inneren Energie:
Der letzte Term entspricht der elektrischen Arbeit die nötig ist um eine
infinitesimale Stoffmenge eines geladenen Teilchens
an einen Ort zu bringen an dem das Elektrische
Potential
vorherrscht.
ist dabei die Faraday-Konstante
und
die Oxidationszahl
des Teilchens
.
Diese abstrakte Definition kann man wie folgt beschreiben. Die elektrische
Arbeit ist über die Gleichung
definiert, wobei
die Ladung und
die elektrische Potentialdifferenz darstellen. Abhängig von der Richtung des
elektrischen Feldes und der Ladung (positiv oder negativ) eines Teilchens muss
man also Energie aufwenden um ein geladenes Teilchens gegen eine elektrische
Potentialdifferenz zu bewegen oder sie wird frei wenn das Teilchen durch die
Potentialdifferenz beschleunigt wird. Dieser elektrische Arbeitsterm ist in die
obige Gleichung eingefügt worden. Die Ladung kann für die infinitesimale
Stoffmenge eines Teilchen durch
geschrieben werden. An Stelle einer Potentialdifferenz tritt das elektrische
Potential
,
wobei als Referenz das elektrische Potential in unendlicher Entfernung tritt und
willkürlich Null gesetzt wird. Die Interpretation des elektrischen Arbeitsterms
für ein Teilchen
kann nun folgendermaßen gegeben werden. Er entspricht der elektrischen Arbeit
die notwendig ist um eine infinitesimale Stoffmenge eines elektrisch geladenen
Teilchens von unendlicher Entfernung an einen Ort zu bringen an dem das
elektrische Potential
vorherrscht.
Mit dem zusätzlich eingefügten Term für die elektrische Arbeit wird die partielle Ableitung der inneren Energie nach der Stoffmenge einer Komponente zu:
Diese partielle Ableitung ist nun als das elektrochemische Potential
definiert:
Das elektrochemische Potential tritt also an die Stelle des chemischen Potentials wenn geladene Teilchen behandelt werden.
Werte
Die Werte des chemischen Potentials sind für Standardbedingungen (;
)
tabelliert.
Ist das chemische Potential für einen bestimmten Zustand (z.B. Standardbedingungen) bekannt, so lässt es sich für Drücke und Temperaturen in der Umgebung dieses Zustandes in linearer Näherung berechnen:
mit
- dem Temperaturkoeffizienten
- der Druckkoeffizienten
Aus den Maxwell-Beziehungen folgt, dass
- der Temperaturkoeffizient gleich der negativen molaren Entropie ist:
und
- der Druckkoeffizient gleich dem molaren Volumen:
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 21.01. 2023