
Seignettesalz
| Sicherheitshinweise | ||||||
|---|---|---|---|---|---|---|
| ||||||
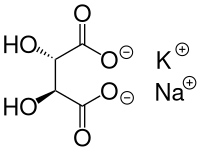
Seignettesalz ist ein Salz der Weinsäure. Es ist ein Doppelsalz, das Kalium- und Natriumionen enthält, mit der heutigen korrekten Bezeichnung Kalium-Natrium-Tartrat-Tetrahydrat (KNaC4H4O6 · 4 H2O). Die Tartrate sind die Salze der Weinsäure, Seignettesalz leitet sich von den beiden Basen Kali- und Natronlauge ab.
Das Seignettesalz wurde in La Rochelle entdeckt und wird daher auch Rocheller Salz genannt. Veraltete Bezeichnungen sind weinsaures Natronkalium oder Natronweinstein. Die wegen der Anwendung in der Pharmazie (mildes Brechmittel) wichtigen lateinischen Namen sind Tartarus natronatus, Natrokali tartaricum, Kalium tartaricum natronatum (frz. Tartrate de soude et de potasse, Sel de seignette, engl. Tartarated soda, Salt of seignette).
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Seignettesalz |
| Andere Namen | |
| Summenformel | C4H4KNaO6 (wasserfrei) |
| Kurzbeschreibung | farbloser Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| EG-Nummer | 613-385-0 |
| ECHA-InfoCard | 100.132.041 |
| Eigenschaften | |
| Molare Masse |
|
| Aggregatzustand | fest |
| Dichte | 1,79 g/cm3 |
| Schmelzpunkt | 70–80 °C (Tetrahydrat) |
| Siedepunkt | Zersetzung bei 220 °C (wasserfrei) |
| Löslichkeit |
|
Geschichte
Der französische Apotheker, nach dem es benannt wurde, Elie Seignette (1632–1698), entdeckte es zwischen 1648 und 1660.
Am Seignettesalz wurde die Ferroelektrizität entdeckt.
Herstellung
Kaliumnatriumtartrat kann aus Weinstein und Soda hergestellt werden, indem man eine Lösung von Soda mit Weinstein versetzt, bis kein Entweichen von Kohlensäure mehr stattfindet. Nach dem Eindampfen der filtrierten Lauge im Dampfbad bilden sich schöne Kristalle, die bei sehr geringer Wärme getrocknet werden, da sie sonst durch Verlust von Kristallwasser ihre Durchsichtigkeit bzw. Transparenz verlieren.
Eigenschaften

Die Kristalle bilden große, wasserhelle, rhombische Säulen. Das Salz schmilzt beim Erwärmen in seinem Kristallwasser, ist aber sonst ziemlich luftbeständig. Es löst sich in sehr wenig Wasser und besitzt einen milden salzigen Geschmack.
Das Tetrahydrat verliert bei 100 °C drei Moleküle Kristallwasser und geht bei 130–140 °C in den wasserfreien Zustand über. Es zersetzt sich bei 220 °C.
Zwischen −18 °C und +24 °C sind Kaliumnatrium-(R,R)-tartrat-Kristalle Ferroelektrika.
Verwendung
In der analytischen Chemie wird es als Hilfsmittel zum Nachweis von reduzierenden Zuckern mit der Fehlingschen Lösung II oder mit Nylanders Reagenz gebraucht. Dabei wird ausgenutzt, dass es ein guter Chelator (Komplexbildner) ist und Kupfer- bzw. Bismutionen komplexiert und dabei bindet.
Als Chelator kann anstelle des Salzes von Seignette auch ein anderes Tartrat verwendet werden, das mit entsprechenden Atomen ein ungeladenes Molekül bildet, solange dieses nicht selbst als Ligand für die Komplexbindung mit dem Seignettesalz in Frage kommt. Dass das käufliche Seignettesalz aus Kaliumnatriumtartrat zusammengesetzt ist, hängt mit den Kosten für dieses Produkt zusammen. Kaliumhydrogentartrat kommt sehr häufig in der Natur vor und lässt sich auf einfache Art und Weise gewinnen. Auch das für die Dosierung und die Neutralisation erforderliche Carbonat eines Alkalimetalls ist relativ billig, sobald Natriumcarbonat verwendet wird.
Wegen seiner piezoelektrischen Eigenschaft wurde es zur Herstellung des Kristalltonabnehmers verwendet.
Es ist in der EU als Lebensmittelzusatzstoff der Nummer E 337 zugelassen (Verwendung meist als Säureregulator). Es wird auch als ein kühlendes, leicht abführendes Mittel, z.B. als Seidlitzpulver, angewandt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025