Lithiumperoxid
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Lithiumperoxid, Li2O2 ist eine Sauerstoffverbindung des Alkalimetalls Lithium.
| Kristallstruktur | |
|---|---|
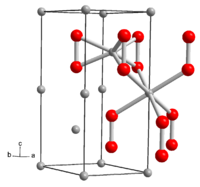 | |
| _ Li+ _ O− | |
| Allgemeines | |
| Name | Lithiumperoxid |
| Andere Namen |
Dilithiumperoxid |
| Verhältnisformel | Li2O2 |
| Kurzbeschreibung | weißer Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 12031-80-0 |
| EG-Nummer | 234-758-0 |
| ECHA-InfoCard | 100.031.585 |
| PubChem | 25489 |
| Eigenschaften | |
| Molare Masse | 45,88 g/mol |
| Aggregatzustand | fest |
| Dichte | 2,36 g/cm3 |
| Schmelzpunkt | Zersetzung ab 340 °C |
| Löslichkeit | exotherme Reaktion mit Wasser |
Herstellung
Die Darstellung erfolgt durch Umsetzung von Lithiumhydroxid mit Wasserstoffperoxid und anschließendem Erhitzen unter Abspaltung von Wasserstoffperoxid
Eigenschaften
Lithiumperoxid ist ein in reinster Form farbloser, gewöhnlich gelblicher Feststoff. Mit Wasser erfolgt Bildung von Wasserstoffperoxid. Die Verbindung hat eine hexagonale Kristallstruktur mit der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) und den Gitterparametern a = 3,183 Å und c = 7,726 Å. Die Kristallstruktur enthält zwei kristallographisch verschiedene Li-Atome. Eines ist von den sechs Sauerstoffatomen dreier Perioxidionen koordiniert, das zweite in einem verzerrten Oktaeder von den Sauerstoffatomen sechs benachbarter Peroxidionen. Die Standardbildungsenthalpie von Lithiumperoxid beträgt ΔHf0 = −633 kJ/mol.
Verwendung
Lithiumperoxid kann zur Herstellung hochreinen Lithiumoxids eingesetzt werden. Hierbei wird Lithiumperoxid bei 195 °C zersetzt, wobei sich Lithiumoxid und Sauerstoff bilden:
Des Weiteren wird es in der Raumfahrt zur Regeneration der lebenserhaltenden Gasversorgungssysteme eingesetzt. Mit Kohlenstoffdioxid reagiert es zu Lithiumcarbonat und Sauerstoff. Hierdurch wird der Atemluft Kohlenstoffdioxid entzogen und Sauerstoff freigesetzt.
Lithiumperoxid findet Verwendung als Härter für spezielle Polymere. Es wird weiterhin für die sich in der Entwicklung befindenden Lithiumperoxid-Akkumulatoren verwendet bzw. beim Entladebetrieb in der Batterie gebildet.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.03. 2022

