
Tetrafluorsilan
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
Tetrafluorsilan (SiF4), eine Siliciumverbindung aus der Gruppe der Siliciumtetrahalogenide. Es ist ein farbloses, giftiges, unbrennbares Gas. In der Halbleiterindustrie entsteht Siliciumtetrafluorid beim Entfernen von Siliciumdioxid-Schichten auf Wafern mittels Flusssäure.
| Strukturformel | |
|---|---|
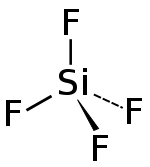 | |
| Allgemeines | |
| Name | Tetrafluorsilan |
| Andere Namen |
|
| Summenformel | SiF4 |
| Kurzbeschreibung | farbloses Gas mit stechendem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 7783-61-1 |
| EG-Nummer | 232-015-5 |
| ECHA-InfoCard | 100.029.104 |
| PubChem | 24556 |
| Eigenschaften | |
| Molare Masse | 104,1 g/mol |
| Aggregatzustand | gasförmig |
| Dichte | 4,372 kg/m3 (15 °C) |
| Sublimationspunkt | −95,2 °C |
| Löslichkeit | hydrolysiert in Wasser |
Herstellung
Verfahren 1
Hergestellt wird es aus Calciumfluorid und Siliciumdioxid (Sand) mit konzentrierter Schwefelsäure. Folgende Reaktionen laufen ab: Umsetzung von Fluorit zu Fluorwasserstoff
Der Fluorwasserstoff reagiert dann mit dem SiO2
Unter Säureüberschuss wird die Hydrolyse von SiF4 verhindert.
Das so erhaltene SiF4 ist allerdings nur 80 bis 90%ig. Es enthält sauerstoffhaltige Produkte wie F3Si–O–SiF3 oder F3Si–O–SiF2–O–SiF3. Beim Transport von SiF4 in Pipelines zerfallen diese Moleküle in SiF4 und SiO2. Dabei setzt das SiO2 die Rohrleitungen zu. Die chemische Industrie hatte das Verfahren des Transportes von SiF4 in Pipelines anstelle des gefährlicheren Fluorwasserstoffs entwickelt, um entferntere Produktionsstätten per Pipeline mit Fluoriden zu versorgen. Aufgrund der geschilderten Probleme fand dieses Verfahren jedoch keine Verbreitung.
Verfahren 2
Beim Erhitzen von Bariumfluorosilikat entsteht SiF4, es kann auch Ammoniumhexafluorosilicat oder die Hexafluorokieselsäure selbst verwendet werden:
Verfahren 3
Im Labormaßstab lässt sich Tetrafluorsilan durch Umsetzung von Tetrachlorsilan mit Calciumfluorid bei 450 bis 500 °C darstellen:
Eigenschaften
Siliciumtetrafluorid hat einen stechenden Geruch und ist bei Feuchtigkeit stark rauchend, wobei der Rauch aus Fluorokieselsäure und Siliciumdioxid besteht. Es wechselt beim Abkühlen durch Resublimation von der gasförmigen Phase direkt in die feste Phase. Das Gas ist ab einem Druck von 50 atm verflüssigbar. Seine kritische Temperatur liegt bei −14,15 °C, sein kritischer Druck bei 37,2 bar, seine Tripelpunkttemperatur bei −86,8 °C und sein Tripelpunktdruck bei 2,240 bar.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.02. 2024


