
Blei(II)-sulfid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
Blei(II)-sulfid ist eine chemische Verbindung aus den Elementen Blei und Schwefel. Es ist ein Salz mit der Verhältnisformel PbS.
| Kristallstruktur | |
|---|---|
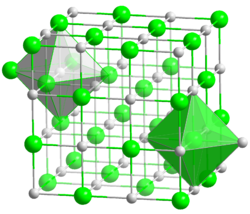 | |
| __ Pb2+ __ S2− | |
| Kristallsystem | kubisch |
| Raumgruppe | Fm3m (Nr. 225) |
| Koordinationszahlen |
Pb[6], S[6] |
| Allgemeines | |
| Name | Blei(II)-sulfid |
| Andere Namen | Bleisulfid |
| Verhältnisformel | PbS |
| Kurzbeschreibung | schwarzer, geruchloser Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 1314-87-0 |
| EG-Nummer | 215-246-6 |
| ECHA-InfoCard | 100.013.861 |
| PubChem | 14819 |
| Eigenschaften | |
| Molare Masse | 239,27 g/mol |
| Aggregatzustand | fest |
| Dichte | 7,5 g/cm3 |
| Schmelzpunkt | 1114 °C |
| Löslichkeit |
|
Vorkommen
Blei(II)-sulfid kommt in der Natur in großen Mengen in Form des Minerals Galenit (Bleiglanz) vor.
Gewinnung und Darstellung
Blei(II)-sulfid kann durch Einleiten von Schwefelwasserstoff oder Zugabe einer Natriumsulfid-Lösung in eine Blei-Salzlösung hergestellt werden.
Während bei der Fällung von Blei-Salzlösungen nur rein amorphe oder teilweise kristallisierte Blei(II)-sulfid-Niederschläge erhalten werden, lässt sich durch Umsetzung von Natriumtetrahydroxoplumbat(II)-lösung mit Thioharnstoff ein gleichmäßig kristallisiertes Blei(II)-sulfid von annähernd einheitlicher Kristallgröße darstellen.
Eigenschaften

Blei(II)-sulfid bildet große, bleigraue, metallglänzende Kristalle, die sich leicht spalten lassen. Die Gitterstruktur entspricht der von Natriumchlorid.
Die Verbindung ist schwer löslich in Wasser, ebenso in kalter verdünnter Salzsäure und Schwefelsäure. Durch Einleiten von Schwefelwasserstoff in eine Blei(II)-Salzlösung fällt aufgrund des Überschreiten des Löslichkeitsproduktes ein schwarzer Niederschlag von PbS aus:
- Gelöste Blei-Ionen bilden mit Sulfid (S2−) schwerlösliches Blei(II)-sulfid.
Mit dieser empfindlichen Reaktion lassen sich sehr geringe Spuren von Blei im Wasser nachweisen. Leicht löslich dagegen ist Blei(II)-sulfid in Salpetersäure. In konzentrierter Salzsäure zersetzt es sich in unter Schwefelwasserstoff-Entwicklung:
- Blei(II)-sulfid reagiert mit konzentrierter Salzsäure zu Blei(II)-chlorid und Schwefelwasserstoff.
Blei(II)-sulfid schmilzt bei 1114 °C.
Beim Erhitzen an der Luft (Rösten) verbrennt die Verbindung schließlich selbständig zu Blei(II)-oxid:
- Blei(II)-sulfid reagiert mit Luft-Sauerstoff zu Blei(II)-oxid, Blei(II)-sulfat und Schwefeldioxid.
Verwendung
Bleisulfid ist ein Halbleiter und wird als Detektormaterial für Infrarotempfänger (z.B. in Teleskopen) verwendet. Weiterhin wird es als Vulkanisationsbeschleuniger in der Kautschukindustrie und als Rohstoff in der Glas- und Keramikindustrie eingesetzt. Ferner dient es als Hilfsstoff zur Emittierung spezieller Frequenzbänder bei Flares.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.01. 2025


