
Leucin
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
Leucin, abgekürzt Leu oder L, ist eine proteinogene α-Aminosäure. Es kristallisiert in weißen Plättchen, wovon sich auch der Name herleitet (gr. λευκός: weiß).
Leucin gehört zusammen mit seinen Konstitutionsisomeren Isoleucin, Norleucin und tert-Leucin zur Stoffgruppe der Leucine.
Isomere
Für höhere Lebewesen ist L-Leucin [Synonym: (S)-Leucin] eine essentielle Aminosäure, die vermutlich für den Energiehaushalt im Muskelgewebe eine zentrale Rolle spielt. Das Spiegelbildisomer (Synonym: Enantiomer) von L-Leucin ist das D-Leucin [Synonym: (R)-Leucin]. Letzteres kommt in Proteinen nicht vor.
| Strukturformel | ||
|---|---|---|
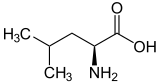
| ||
| Struktur von L-Leucin, dem natürlich vorkommenden Isomer | ||
| Allgemeines | ||
| Name | Leucin | |
| Andere Namen |
| |
| Summenformel | C6H13NO2 | |
| Kurzbeschreibung | schimmernd weiße Kristallschuppen | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 200-522-0 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Arzneistoffangaben | ||
| ATC-Code | ||
| Eigenschaften | ||
| Molare Masse | 131,18 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,29 g/cm3 | |
| Schmelzpunkt | 293–295 °C | |
| pKS-Wert |
| |
| Löslichkeit |
| |
In diesem Text betreffen die Angaben zur Physiologie allein das L-Leucin [Synonym: (S)-Leucin]. Wenn in diesem Artikel und in der wissenschaftlichen Literatur ohne jeden Zusatz „Leucin“ erwähnt wird, ist stets L-Leucin gemeint. Racemisches DL-Leucin [Synonym: (RS)-Leucin] und enantiomerenreines D-Leucin [Synonym: (R)-Leucin] sind synthetisch zugänglich und besitzen nur geringe praktische Bedeutung. Die Racemisierung von L-Aminosäuren kann zur Aminosäuredatierung – einer Altersbestimmung für fossiles Knochenmaterial – herangezogen werden.
L-Leucin wird von den Codons UUA, UUG, CUU, CUC, CUA und CUG kodiert.
| Isomere von Leucin | ||
| Name | L-Leucin | D-Leucin |
| Andere Namen | (S)-Leucin | (R)-Leucin |
| Strukturformel |  |
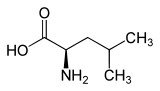
|
| CAS-Nummer | ||
| EG-Nummer | 200-522-0 | 206-327-7 |
| 206-328-2 (Racemat) | ||
| ECHA-Infocard | ||
| PubChem | ||
| – (Racemat) | ||
| DrugBank | ||
| − (Racemat) | ||
| FL-Nummer | 17.012 | - |
Geschichte
1819 konnte der französische Pharmazeut und Chemiker Joseph Louis Proust zwei Substanzen aus Weizenmehl isolieren, die er als „acide caséique“ und „oxide caséeux“ bezeichnete. Ein Jahr darauf isolierte Henri Braconnot eine scheinbar neue Substanz durch saure Hydrolyse aus Muskelfaser und Wolle und nannte diese aufgrund der weißen Färbung der Kristalle Leucin. Eduard Mulder erkannte 1839 die Identität der beiden Stoffe und diskutierte die mögliche Zusammensetzung. Aber erst 1891 gelang es dem deutschen Chemiker Ernst Schulze und seinem Doktoranden Arthur Likernik die Konstitution von L-Leucin richtig festzustellen.
Vorkommen
Leucin ist – peptidisch gebunden – Bestandteil tierischen und pflanzlichen Proteins. Die folgenden Beispiele beziehen sich jeweils auf 100 g des Lebensmittels, zusätzlich ist der prozentuale Anteil von Leucin am Gesamtprotein angegeben:
| Lebensmittel | Gesamtprotein | Leucin | Anteil |
|---|---|---|---|
| Rindfleisch, roh | 21,26 g | 1691 mg | 8,0 % |
| Hähnchenbrustfilet, roh | 23,09 g | 1732 mg | 7,5 % |
| Lachs, roh | 20,42 g | 1615 mg | 7,9 % |
| Hühnerei | 12,58 g | 1088 mg | 8,6 % |
| Kuhmilch, 3,7 % Fett | 3,28 g | 321 mg | 9,8 % |
| Walnüsse | 15,23 g | 1170 mg | 7,7 % |
| Weizen-Vollkornmehl | 13,70 g | 926 mg | 6,8 % |
| Mais-Vollkornmehl | 6,93 g | 850 mg | 12,3 % |
| Reis, ungeschält | 7,94 g | 657 mg | 8,3 % |
| Erbsen, getrocknet | 24,55 g | 1760 mg | 7,2 % |
Eigenschaften
- Restname: Leucyl-
- essentiell: ja
- Seitenkette: lipophil
- Van-der-Waals-Volumen: 124
- Hydrophobizitätsgrad: 3,8
Leucin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert.
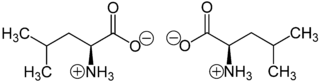
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (bei einem bestimmten pH-Wert) der Fall, bei dem das Leucin auch seine geringste Löslichkeit in Wasser hat. Der isoelektrischer Punkt liegt bei 5,98. Racemisches Leucin, welches zum besseren Verständnis der Homochiralität in der Biosphäre zirkular polarisierter Synchrotron-Strahlung ausgesetzt wurde, zeigt einen Enantiomerenüberschuss von 2,6 %.
Funktionen
L-Leucin ist wichtig für den Erhalt und Aufbau von Muskelgewebe. Es unterstützt die Proteinbiosynthese in Muskulatur und Leber, hemmt den Abbau von Muskelprotein und unterstützt Heilungsprozesse. Wie L-Isoleucin kann auch L-Leucin als Energielieferant dienen.
Die Einschätzungen des Tagesbedarfs für gesunde Erwachsene reichen, je nach verwendeter Methode, von 10 bis 50 mg Leucin pro Kilogramm Körpergewicht. Ein Mangel ist entweder durch ungenügende Zufuhr mit der Nahrung oder Unterversorgung mit Vitamin B6 bedingt.
Verwendung
L-Leucin ist neben Glycin und anderen proteinogenen L-Aminosäuren Bestandteil von medizinischen Infusionslösungen.
Im Kraftsport wird Leucin als Nahrungsergänzungsmittel für den Muskelaufbau verwendet.
Siehe auch
Literatur
- Hans Beyer und Wolfgang Walter: Lehrbuch der Organischen Chemie, 20. Auflage, S. Hirzel Verlag, Stuttgart, 1984, ISBN 3-7776-0406-2.
- Hans-Dieter Jakubke und Hans Jeschkeit: Aminosäuren, Peptide, Proteine, Verlag Chemie, Weinheim, 1982, ISBN 3-527-25892-2.
- Jesse Philip Greenstein und Milton Winitz: Chemistry of Amino Acids, John Wiley & Sons, 1962, Bände 1 bis 3, ISBN 0-471-32637-2.
- Yoshiharu Izumi, Ichiro Chibata und Tamio Itoh: Production and Utilization of Amino Acids, In: Angewandte Chemie International Edition in English, 1978,
17, S.176–183,
 doi:10.1002/anie.197801761.
doi:10.1002/anie.197801761.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025