
Ratengleichung
Ratengleichungen sind Gleichungen, welche bei gekoppelten chemischen Reaktionen den zeitlichen Konzentrationsverlauf verschiedener chemischer Stoffe beschreiben, oder bei An- und Abregungsprozessen den Besetzungsverlauf der Energieniveaus in Atomen oder Molekülen.
Ratengleichungen beschreiben die Reaktionskinetik.
Die Änderungsrate der Konzentration
einer Spezies
ist die Summe der Änderungsraten der Konzentrationen, welche durch verschiedene
Reaktionen hervorgerufen werden:
,
wobei
die betrachtete Spezies ist,
ihre Konzentration und
ein Index ist, der über alle auftretenden Reaktionen (also auch jeweils über die
Hin- und Rückreaktion) läuft.
ist die Reaktionsgeschwindigkeit
der Reaktion
.
Die Reaktionsgeschwindigkeit
ist proportional zum Produkt der Eduktaktivitäten
der Reaktion
,
mit der Geschwindigkeitskonstante
der Reaktion als Proportionalitätskonstante:
.
Dadurch ergibt sich die die Ratengleichung als:
wobei
die Aktivität der Spezies
– häufig wird vereinfachend die Konzentration
verwendet –,
die stöchiometrischen Koeffizienten der Spezies
in der Reaktion
,
die Beträge der stöchiometrischen Koeffizienten, falls die Ratengleichung mit Aktivitäten aufgestellt ist, oder die partiellen Reaktionsordnungen der Spezies
in der Reaktion
(im Allgemeinen ungleich den stöchiometrischen Koeffizienten), falls die Ratengleichung mit Konzentrationen aufgestellt ist,
die Ratenkoeffizienten (i.A. Geschwindigkeitskonstanten),
die Anzahl der Reaktionen und
die Anzahl der beteiligten Stoffe in der Reaktion
ist.
Bei den Ratengleichungen handelt es sich im Allgemeinen um ein System von
gekoppelten, steifen,
nichtlinearen Differentialgleichungen
erster Ordnung, für die die Bausteinerhaltung gelten muss. Im stationären
Fall
ergibt sich das Massenwirkungsgesetz.
Ratengleichungen können kompakt mithilfe der Stöchiometrischen
Matrix dargestellt werden.
Durch Lösung der Differentialgleichungen erhält man den zeitlichen Verlauf der mittleren Konzentrationen. Um Realisierungen der Konzentrationen inklusive Fluktuationen zu erhalten, können stochastische Simulationen mit dem Gillespie-Algorithmus ausgeführt werden.
Herleitung
Die Ratengleichungen lassen sich für alle beteiligten Spezies herleiten, indem die Kontinuitätsgleichung mit Quell- beziehungsweise Senkterm (bzw. eine Bilanzgleichung) für die Teilchenkonzentrationen aufgestellt werden:
,
wobei
der Quellterm ist, welcher von den Aktivitäten
abhängt. Diese Aktivitäten sind im Allgemeinen wiederum nichttrivial von allen
Konzentrationen abhängig.
Da eine Gleichgewichtsreaktion immer eine Hinreaktion und eine Rückreaktion
besitzt, existieren die Hin-Reaktionsrate
und die Rück-Reaktionsrate
.
Der Quellterm ist durch eine Summe über alle Reaktionen gegeben:
Man beachte, dass die partielle Reaktionsordnung (der Exponent, mit dem die Konzentrationen eingehen) nur dann dem Betrag der stöchiometrischen Koeffizienten entspricht, wenn Aktivitäten verwendet werden. Werden statt Aktivitäten ebenfalls Konzentrationen im Quellterm verwendet und liegen Teilchenwechselwirkungen vor, so sind die Beträge der stöchiometrischen Koeffizienten mit den partiellen Reaktionsordnungen zu ersetzen. Die partielle Reaktionsordnung kann beliebige Werte annehmen (z.B. 0) und wird experimentell bestimmt.
Verschiedene Fälle
- Im Gleichgewicht gibt es keine Teilchenströme (
) und die Teilchenkonzentrationen ändern sich nicht mehr zeitlich. Daher gilt im Gleichgewicht:
-
- Unter der Annahme, dass jede Reaktion (als Paar von Hin- und Rückreaktion)
im Einzelnen ausgeglichen ist, erhält man für jede Reaktion das Massenwirkungsgesetz
durch Umformung:
- Ist das System im Nichtgleichgewicht, aber homogen, so treten keine Teilchenströme auf, jedoch ändern sich die Konzentrationen zeitlich, bis das Gleichgewicht erreicht ist:
- Für den Fall, dass man ein inhomogenes System im Nichtgleichgewicht
betrachtet, ist der Teilchenstrom
und kann durch das erste Fick’sche Gesetz
-
- beschrieben werden (wobei der nicht-ideale Exzess-Term nur für nicht-ideale Systeme auftritt). Man erhält dann eine Reaktionsdiffusionsgleichung.
- Für den Fall, dass es zusätzlich Strömung im System gibt, ist Konvektion im Teilchenstrom zu berücksichtigen und man erhält die Konvektions-Diffusions-Gleichung.
Ratenkoeffizenten
Die in den Ratengleichungen auftretenden Reaktionsratenkoeffizienten können allgemein als beliebige Funktionen der jeweiligen, gegebenenfalls zeitabhängigen Temperatur (siehe auch Plasmaphysik: Thermisches Gleichgewicht) betrachtet werden. Im Allgemeinen müssen Ratenkoeffizienten für chemische Prozesse der schweren Teilchen aus der Literatur entnommen werden ('Geschwindigkeitskonstante' einer chemischen Reaktion), die Ratenkoeffizienten für die elektronenstoßinduzierten Prozesse können mit Hilfe der Elektronenkinetik erhalten werden.
Grundlage für die kinetische Behandlung der Elektronen, sowohl zur Berechnung derartiger Ratenkoeffizienten, als auch elektronischer Transportprozesse (elektrische Leitfähigkeit) bildet die Boltzmann-Gleichung für die Elektronenenergieverteilung.
Beispiele
Wasserstoffoxidation
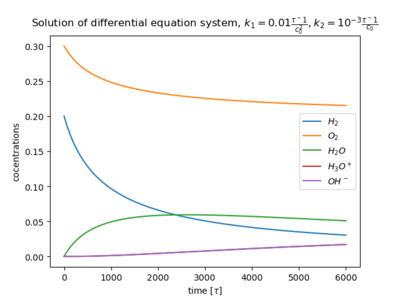
Zur Verdeutlichung wird die Wasserstoffoxidation herangezogen:
| (Ratenkoeffizient: |
ein Teil dissoziiert
| (Ratenkoeffizient: |
Die Ratengleichungen (Gl.1) für die fünf Spezies lauten:
Die Konzentrationen der Spezies:
Belousov-Zhabotinsky-Reaktion
Oszillierende Reaktionen werden durch Ratengleichungen beschrieben. Für spezielle Modelle hierzu, Oregonator und Brüsselator. Die numerische Lösung solcher Differentialgleichungssysteme liefert dann oszillierende chemische Konzentrationen.
Lotka-Volterra-Gleichungen
Die Wechselwirkung von Räuber- und Beutepopulationen wird durch die Lotka-Volterra-Gleichungen beschrieben.
Numerische Lösungsmethoden
Da es sich bei den Ratengleichungen um ein System von steifen Differentialgleichungen handelt, ist man gezwungen ein Verfahren mit einem möglichst großen Stabilitätsgebiet zu wählen, damit die Integrationsschritte nicht allzu klein werden. Am günstigsten sind A-stabile Verfahren.
Für die Ratengleichungen bedeutet 'steif', dass sich die Zeitkonstanten der verschiedenen Spezies sehr stark unterscheiden: Im Verhältnis zu anderen ändern sich einige Konzentrationen nur sehr langsam. Zwei Beispiele absolut steif-stabiler Integrationsverfahren sind die Implizite Trapez-Methode und die Implizite Euler-Methode, ebenso sind einige BDF-Verfahren (backward differentiation formula) geeignet.
Bausteinerhaltung
Das Prinzip der Bausteinerhaltung liefert eine Möglichkeit, die Güte der numerischen Lösungen zu überprüfen, denn es gilt zu jedem Zeitpunkt:
wobei
Minimale Anzahl der Bausteine,
Anzahl an den Reaktionen beteiligten Spezies.
Herleitung
Eine Spezies i, hier geschrieben als
setzt sich dabei aus den Bausteinen
folgendermaßen zusammen:
.
in die Ratengleichung (Gl.1) eingesetzt und über alle Spezies summiert,
liefert wegen
die oben genannte Bausteinerhaltung.
Beispiel für die Matrix βik
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 07.01. 2026