
Flavin-Adenin-Dinukleotid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
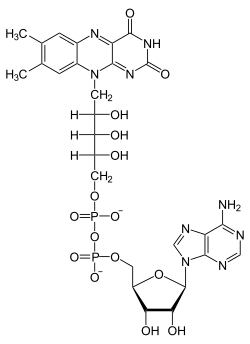
Flavin-Adenin-Dinukleotid, abgekürzt FAD ist ein Coenzym. Es hat eine wichtige Bedeutung als Elektronenüberträger in verschiedenen prokaryotischen und eukaryotischen Stoffwechselprozessen, wie der oxidativen Phosphorylierung[1], der β-Oxidation von Fettsäuren, der Atmungskette und anderen Redoxreaktionen.[2] FAD kann im Gegensatz zum NAD+ einzelne Elektronen übertragen.[2] Oxidoreduktasen können somit mittels FAD molekularen Sauerstoff aktivieren.[3]
Struktur und chemische Eigenschaften
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeines | ||
| Name | Flavin-Adenin-Dinukleotid | |
| Andere Namen | DISODIUM FLAVINE ADENINE DINUCLEOTIDE (INCI) | |
| Summenformel | C27H33N9O15P2 | |
| Kurzbeschreibung | gelber Feststoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 205-663-1 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 785,55 g/mol | |
| Aggregatzustand | fest | |
| Löslichkeit | löslich in Wasser | |
FAD besteht aus Adenosindiphosphat, das mit Riboflavin (Vitamin B2) verknüpft ist. Alternativ könnte man auch sagen, es bestehe aus Adenosin-Monophosphat (AMP), an welchem Flavinmononukleotid (FMN) gebunden ist. Die „reaktiven“ Stickstoffatome befinden sich im Isoalloxazinring des Moleküls.
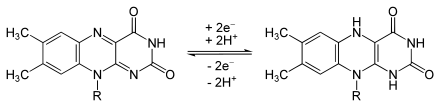
Das oxidierte FAD geht durch Aufnahme zweier Protonen (H+) und zweier Elektronen (e−) in die reduzierte Form FADH2 über: Man bezeichnet dies als einen ECEC-Mechanismus (e für elektrochemischer Schritt, c für chemischer Schritt der Protonierung), wobei die zweite Protonierung nur in ausreichend saurer Lösung erfolgt. Der Übergang zwischen dem ECE-Mechanismus ohne abschließende Übertragung eines Protons und des ECEC-Mechanismus ist außerdem noch von der chemischen Umgebung abhängig: Für freies FAD in Lösung überlappen ECE- und ECEC-Mechanismus bei pH 6,7[4], auf Oberflächen immobilisiertes FAD wird erst bei etwa pH 9 nach dem ECE-Mechanismus reduziert.[5]
Das Redoxpotential des FAD liegt unter Standardbedingungen bei −219 mV vs. NHE.[4]
Eine Lösung von Flavin-Adenin-Dinukleotid in Wasser (10 g/l) besitzt einen pH-Wert von etwa 6.
Enzyme, die FAD verwenden>
Zu den Enzymen, die FAD verwenden, gehören die:
- Monoamin-Oxidase
- Ferredoxin-NADP+ Reduktase
- Glucose-Oxidase (GOx)
- Cellobiose Dehydrogenase
- Nitratreduktase
- Succinat-Dehydrogenase
- Dihydrolipoyl-Dehydrogenase
- Acyl-CoA-Dehydrogenase
Siehe auch
Einzelnachweise
- ↑ U. Dettmer, M. Folkerts, E. Kächler, A. Sönnichsen: Intensivkurs Biochemie, 1. Auflage, Elsevier Verlag, München 2005, ISBN 3-437-44450-6, S. 10
- ↑ Hochspringen nach: a b K. Aktories, U. Förstermann, F. B. Hofmann, K. Starke: Allgemeine und Spezielle Pharmakologie und Toxikologie: Begründet von W. Forth, D. Henschler, W. Rummel, 10. Auflage, Elsevier Verlag, München, ISBN 3-437-42522-6, S. 762.
- ↑ H. Renz: Integrative Klinische Chemie und Laboratoriumsmedizin. Pathophysiologie – Pathobiochemie – Hämatalogie, 1. Auflage, de Gruyter Verlag, Berlin 2003, ISBN 3-11-017367-0, S. 616.
- ↑ Hochspringen nach: a b Müller, F.; Chemistry and Biochemistry of Flavoenzymes, 1991, Vol. 1, CRC Press London.
- ↑ Nöll et al., In: Langmuir B, 2006, 22, S. 2378–2383.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 30.10. 2025