Alloxazin
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Alloxazin ist eine chemische Verbindung aus der Gruppe der Stickstoffheterocyclen. Es leitet sich von Chinoxalin und von Pteridin ab. Alloxazin bildet gelbgrüne Kristalle, deren Lösungen stark fluoreszieren.
| Strukturformel | ||
|---|---|---|
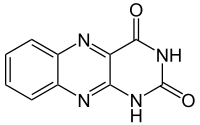
| ||
| Allgemeines | ||
| Name | Alloxazin | |
| Andere Namen |
| |
| Summenformel | C10H6N4O2 | |
| Kurzbeschreibung |
gelbe feine Nadeln[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 207-714-3 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 214,18 g/mol | |
| Aggregatzustand |
fest[1] | |
| Schmelzpunkt |
> 340 °C (Zersetzung)[2] | |
| Löslichkeit |
| |
Herstellung
Die Synthese von Alloxazin durch Umsetzung von o-Phenylendiamin mit Alloxan wurde erstmal 1891 beschrieben.[1]

Bei einer alternativen Darstellung kondensiert man o-Phenylendiamin mit 5,5-Dimorpholinobarbitursäure.[2]
Eigenschaften
Alloxazin fluoresziert in Ethanol im Wellenlängenbereich von 420–480 nm und zeigt in Pyridin eine zusätzliche Absorptionsbande bei 500–560 nm, die charakteristisch für das tautomere Isoalloxazin ist. Das Gleichgewicht der Tautomerie liegt im Grundzustand auf der Seite des Alloxazin. Eine Synthese des unsubstituierten Isoalloxazin ist nicht bekannt.[4]

Die experimentelle Ergebnisse zum Fluoreszenz-Verhalten sind mit einer Phototautomerie von Alloxazin zu Isoalloxazin im angeregten Zustand.[4][5]
Während substituierte Alloxazin-Derivate keine biologische Aktivität zeigen, liegt bei den Flavinen eine Isoalloxazin-Grundstruktur vor, bei der das Stickstoffatom in der 5-Position substituiert ist.[4] Vertreter sind beispielsweise Riboflavin, FAD und Flavinmononukleotid.[6]
Substituierte Isoalloxazine sind über Uracil-Derivate synthetisch leicht zugänglich. Die folgende Abbildung zeigt eine einfache Syntheseroute:[7]
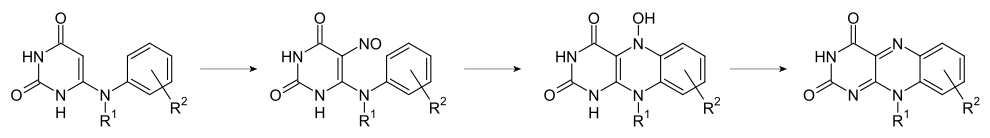
Einzelnachweise
- ↑ Hochspringen nach: a
b c d
O. Kühling: Ueber Azine der Harnsäuregruppe. In:
Berichte der deutschen chemischen Gesellschaft.
Band 24,
Nr. 2, 1891,
S. 2363–2369,
doi:
 10.1002/cber.18910240222.
10.1002/cber.18910240222.
- ↑ Hochspringen nach: a
b Th. Kappe, Erika Reichel-Lender, E. Ziegler:
Synthesen von Heterocyclen, 125. Mitt.: Über kondensierte Chinoxalinderivate. In:
Monatshefte für Chemie / Chemical Monthly.
Band 100,
Nr. 2, 1969,
S. 458–461,
doi:
 10.1007/BF00904088.
10.1007/BF00904088.
- ↑ Hochspringen nach: a b
 Sicherheitsdatenblatt Benzopteridine-2,4(1H,3H)-dione. (PDF) BLD Pharmatech,
Sicherheitsdatenblatt Benzopteridine-2,4(1H,3H)-dione. (PDF) BLD Pharmatech, - ↑ Hochspringen nach: a b
c Pill-Soon Song, Ming Sun, Anna Koziolowa, Jacek Koziol:
Phototautomerism of lumichromes and alloxazines. In:
Journal of the American Chemical Society.
Band 96,
Nr. 13, 1974,
S. 4319–4323,
doi:
 10.1021/ja00820a045.
10.1021/ja00820a045.
- ↑ Robert D. Fugate, Pill‐Soon Song:
Lifetime Study of Phototautomerism of Alloxazine and Lumichromes. In:
Photochemistry and Photobiology. Band 24,
Nr. 5, 1976,
S. 479–481,
doi:
 10.1111/j.1751-1097.1976.tb06858.x.
10.1111/j.1751-1097.1976.tb06858.x.
- ↑ Alfred Tölpel: Chemie und Physik der Milch. Naturstoff – Rohstoff – Lebensmittel. 4. Auflage. Behrr's Verlag, 2016, ISBN 978-3-95468-037-5, S. 342
- ↑ Fumio Yoneda, Yoshiharu Sakuma, Misuzu Ichiba, Kazuko Shinomura: Syntheses of isoalloxazines and
isoalloxazine 5-oxides. A new synthesis of riboflavin, in:
J. Am. Chem. Soc., 1976, 98 (3), S. 830–835;
doi:
 10.1021/ja00419a034.
10.1021/ja00419a034.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 01.04. 2024
