5-Methylcytosin
| Sicherheitshinweise | |||
|---|---|---|---|
|
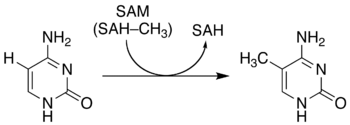
5-Methylcytosin ist eine heterocyclische organische Verbindung mit einem Pyrimidingrundgerüst. Es ist ein Derivat der Nukleinbase Cytosin mit einer zusätzlichen Methylgruppe in Position 5. Dieses Substitutionsmuster entspricht der Analogie zwischen Uracil und Thymin. 5-Methylcytosin bildet die Nukleoside 5-Methylcytidin (5mC, m5C) in der RNA und 5-Methyldesoxycytidin (5-MedC) in der DNA.
Eigenschaften
| Strukturformel | ||
|---|---|---|
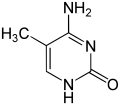
| ||
| Allgemeines | ||
| Name | 5-Methylcytosin | |
| Andere Namen | 4-Amino-5-methyl-1H-pyrimidin-2-on | |
| Summenformel | C5H7N3O | |
| Kurzbeschreibung | kristalliner Feststoff[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 209-058-3 | |
| ECHA-InfoCard | | |
| PubChem | | |
| ChemSpider | | |
| Eigenschaften | ||
| Molare Masse | 125,13 g/mol | |
| Aggregatzustand | fest | |
| Schmelzpunkt | > 270 °C[1] | |
Physikalische Eigenschaften
5-Methylcytosin ist ein kristalliner Feststoff, der bei über 270 °C schmilzt.[1]
Chemische Eigenschaften
Aufgrund seiner chemischen Instabilität kann es zu Thymin desaminieren.[3]
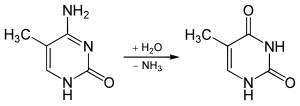
Desaminierung von 5-Methylcytosin zu Thymin
Biologische Bedeutung
5-Methylcytosin ist neben 5-Hydroxymethylcytosin, 5-Formylcytosin und (noch umstritten) 5-Carboxylcytosin eine der modifizierte DNA-Basen, die in Säugetieren gefunden wurde. Daher wird 5-Methylcytosin oft als die fünfte und 5-Hydroxymethylcytosin oft als die sechste DNA-Base bezeichnet. 5-Methylcytosin wird in vivo postreplikativ (nach der DNA-Synthese) aus Cytosin durch Hinzufügen einer Methylgruppe gebildet (DNA-Methylierung).[4] Diese Reaktion wird von DNA-Methyltransferasen (DNMTs) katalysiert.
5-Methylcytosin spielt eine wichtige Rolle in der Epigenetik und ist an der An- und Abschaltung von Genen und wahrscheinlich auch an der Organisation der DNA in Chromosomen beteiligt.[5]
Unter physiologischen Bedingungen desaminiert ein geringer Teil des in der DNA enthaltenen Desoxycytidins zu Desoxyuridin, wofür spezielle Reparatursysteme in den Zellen existieren. Bei der Desaminierung von 5-Methyldesoxycytidin entsteht jedoch das auch normalerweise in der DNA enthaltene Desoxythymidin, das nicht als fehlerhaft erkannt werden kann, wodurch es sich in der nächsten Replikationsrunde mit Desoxyadenosin paaren kann, woraus sich dann eine Transition von Desoxycytidin nach Desoxythymidin und auf dem gegenüberliegenden DNA-Strang von Desoxyguanosin nach Desoxyadenosin ergeben wird.[6]
Literatur
- Melanie Ehrlich, Miguel A. Gama-Sosa, Laura H. Carreira, Lars G. Ljungdahl, Kenneth C. Kuo, Charles W. Gehrke: „DNA methylation in thermophilic bacteria:
N4-methylcytosine, 5-methylcytosine, and N6-methyladenine“, Nucleic Acids Research, 1985, 13 (4), S. 1399–1412
(doi:
 10.1093/nar/13.4.1399;
10.1093/nar/13.4.1399;
 PMC 341080 (freier Volltext);
PMC 341080 (freier Volltext);
 PMID 4000939).
PMID 4000939).
Einzelnachweise
- ↑ Hochspringen nach: a b
c Datenblatt
 5-Methylcytosin bei Thermo Fisher Scientific Inc.
5-Methylcytosin bei Thermo Fisher Scientific Inc.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ G. A. Wagner: Einführung in die Archäometrie, 1. Auflage, Springer Verlag, Berlin 2007, ISBN 3-540-71936-9, S. 282.
- ↑ J. R. Siewert, M. Rothmund, V. Schumpelick: Praxis der Viszeralchirurgie: Onkologische Chirurgie, 3. Auflage, Springer Verlag, Berlin 2010, ISBN 3-642-03807-7, S. 71.
- ↑ Anja Naumann, Norbert Hochstein, Stefanie Weber, Walter Doerfler:
 „5-Methylcytosin als
wichtiger Regulator in der Genetik“ (im Internet Archive) (PDF-Datei; 784 kB).
„5-Methylcytosin als
wichtiger Regulator in der Genetik“ (im Internet Archive) (PDF-Datei; 784 kB).
- ↑ Ralph Remus:
 Verteilung der
fünften DNA-Base 5-Methyl-Desoxycytidin im Säugergenom: DNA Methylierungsmuster endogener retroviraler Sequenzen des Syrischen Hamsters (Mesocricetus auratus) und in den
Promotoren menschlicher Erythrozytenmembranskelettproteine (Homo sapiens), Dissertation 2000, Universität zu Köln
(
Verteilung der
fünften DNA-Base 5-Methyl-Desoxycytidin im Säugergenom: DNA Methylierungsmuster endogener retroviraler Sequenzen des Syrischen Hamsters (Mesocricetus auratus) und in den
Promotoren menschlicher Erythrozytenmembranskelettproteine (Homo sapiens), Dissertation 2000, Universität zu Köln
(  PDF).
PDF).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 19.09. 2025