Hexogen
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Hexogen, auch Cyclotrimethylentrinitramin, Cyclonit, T4 und RDX (Research Department Explosive / Royal Demolition Explosive) genannt, ist ein hochbrisanter, giftiger Sprengstoffaus der Gruppe der Nitramine, der während des Zweiten Weltkriegs in großen Mengen hergestellt wurde und immer noch eingesetzt wird. Der systematische Name von Hexogen lautet 1,3,5-Trinitro-1,3,5-triazinan.
Geschichte
Hexogen wurde 1898 von dem Berliner Chemiker und pharmazeutischen Unternehmer Georg Friedrich Henning als Explosivstoff zur technischen Verwertung und als Ausgangsmaterial für pharmazeutische Präparate erstmals hergestellt und im deutschen Reichspatent unter der Nr. 104280 vom 15. Juli 1898 beschrieben. Im Jahre 1920 erforschte man im Militärversuchsamt in Berlin die Substanz näher und nannte sie nun Hexogen.
Die Herstellungsverfahren waren anfangs unwirtschaftlich. Erst in den 1930er-Jahren wurden vier neue Verfahren in Deutschland entwickelt und Hexogen unter verschiedenen Decknamen wie K-, SH-, E- oder W-Salz im Zweiten Weltkrieg angewendet. Analoge Verfahren wurden auch auf alliierter Seite entwickelt, z.B. das Bachmann-Verfahren in den USA. Hexogen war auch Bestandteil eines der ersten Plastiksprengstoffe, der von Deutschland unter diesem Namen im Zweiten Weltkrieg angewendet wurde und aus 88 % Hexogen und 12 % Vaseline bestand.
Heutzutage werden unterschiedliche Kombinationen verwendet, so z.B. Torpex. Torpex besteht aus 40 % Hexogen, 42 % TNTund 18 % Aluminium.
Hexogen ist chemisch und thermisch sehr stabil und ist auch heute noch einer der brisantesten Sprengstoffe mit hoher Arbeitsleistung. Die Substanz ist der wichtigste praktisch angewendete hochbrisante militärische Explosivstoff.
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Hexogen |
| Andere Namen |
|
| Summenformel | C3H6N6O6 |
| CAS-Nummer | 121-82-4 |
| PubChem | 8490 |
| Eigenschaften | |
| Molare Masse | 222,12 g/mol |
| Aggregatzustand | fest |
| Dichte | 1,82 g/cm3 (20 °C) |
| Schmelzpunkt | 205–206 °C (Zersetzung) |
| Löslichkeit | schlecht in Wasser |
Gewinnung und Darstellung
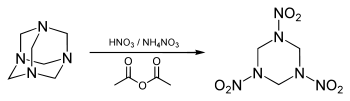
Beim S-H-Verfahren gewinnt man Hexogen durch „Nitrolyse“ aus Hexamethylentetramin (Urotropin, Hexamin) und hochkonzentrierter Salpetersäure (98–99 %). Aufgrund der hohen Explosionsgefahr ist die Herstellung an die Einhaltung genauer Synthesevorschriften gebunden. Technische Verfahren arbeiten modifiziert unter Verwendung von Zusatzstoffen, die Wasser binden (Essigsäureanhydrid im KA- oder Bachmann-Verfahren) und zusätzlich Ammoniumionen liefern (Ammoniumnitrat im K-Verfahren). Hexamethylentetramin (Urotropin) ist ein Kondensationsprodukt aus Ammoniakund Formaldehyd, welches sich beim gemeinsamen Eindampfen der wässrigen, leicht alkalischen Lösungen bildet. Als Nebenprodukt dieser Synthese bilden sich stets einige Prozente Octogen, welches durch Zusätze von Bortrifluorid bevorzugt gebildet werden kann. Beim E-Verfahren erfolgt die Umsetzung von Paraformaldehyd und Ammoniumnitrat in Essigsäureanhydrid.
Die Herstellung und Handhabung von Hexogen hat in der Vergangenheit bereits zu Umwelt- und Trinkwasservergiftungen geführt.
Eigenschaften
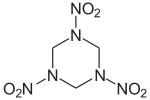
Das Hexogen-Molekül hat eine ringförmige Struktur mit drei Stickstoffatomen (Triazinanring), es ist ein gesättigter Heterocyclus.
Die im Hexogen vorhandenen Nitrogruppen (-NO2) treten in vielen Sprengstoffen auf, zum Beispiel auch im TNToder - als Salpetersäureestergruppe (-O-NO2) - in der Schießbaumwolle. Da die Nitrogruppe an einen Aminstickstoff (dieser enthält ein freies Elektronenpaar) gebunden ist, wird die Struktur stabilisiert (capto-datives Strukturelement). Bei Nitraten ist die Nitrogruppe dagegen an ein Sauerstoffatom gebunden, welcher zwar 2 freie Elektronenpaare besitzt, aber deutlich elektronegativer als der Stickstoff ist. Entsprechend ist die Temperaturstabilität von Nitraminen wesentlich größer als jene vergleichbarer Nitrate.
Physikalische Eigenschaften
Hexogen ist ein farbloser kristalliner Feststoff, der bei 204 °C mit einer Schmelzwärme von 37,66 kJmol−1 schmilzt. Mit einer positiven Bildungsenthalpie von 299,7 kJ·kg−1 bzw. 66,5 kJ·mol−1 handelt es sich um eine endotherme Verbindung. Die Kristallstruktur von Hexogen ist orthorhombisch, Raumgruppe Pbca; a=13,22 Å; b=11,61 Å; c=10,75 Å; Z=8.
Die Härte nach Mohsvon Hexogen liegt bei 2,5.
Explosionskenngrößen
Hexogen zeigt aufgrund seiner hohen Dichte und hohen Detonationsgeschwindigkeit eine hohe Bilanzleistung und zählt zu den leistungsstarken, hochbrisanten und zudem relativ unempfindlichen sowie chemisch sehr stabilen Sprengmitteln. Wichtige Explosionskennzahlen sind:
- Explosionswärme: 5625 kJ/kg (H2O (l)), 5277 kJ/kg (H2O (g)).
- Detonationsgeschwindigkeit: 8750 m/s bei der Maximaldichte.
- Normalgasvolumen: 927 l/kg.
- Spezifische Energie: 1370 kJ/kg.
- Verpuffungspunkt: 230 °C.
- Bleiblockausbauchung: 480 cm3/10 g.
- Schlagempfindlichkeit: 7,4 N·m.
- Reibempfindlichkeit: 120 N Stiftbelastung.
- Stahlhülsentest: Grenzdurchmesser 8 mm.
Verwendung
Hexogen gilt als besonders starker und hochbrisanter Explosivstoff und ist Bestandteil vieler verbreiteter Sprengstoffarten, zum Beispiel C4 und Torpex.
Hexogen ist in reinem Zustand hochexplosiv. Damit es als Sprengstoff militärisch genutzt werden kann, wird es mit Plastifizierern wie Polyethylen,Wachs, Knetmasse, Vaseline oder Ähnlichem zu den Plastiksprengstoffen A2, A3, B2, B3, B4, C2, C3 und dem am weitesten verbreiteten C4 vermischt. Außerdem bilden die Sprengstoffe Hexogen und PETN zusammen mit einem Plastifizierer den ebenfalls bekannten Plastiksprengstoff Semtex. Wie fast alle militärisch verwendeten Sprengstoffe sind alle diese Plastiksprengstoffe nicht mehr gegen Schlag, Flamme und Reibung empfindlich. Um diese Plastiksprengstoffe zur Explosion zu bringen, muss eine Initialzündung mit einer Sprengkapsel erfolgen. Mit bestimmten anderen chemischen Verbindungen kann Hexogen jedoch auch direkt zur Explosion kommen.
Früher fand Hexogen in Brotteig eingeknetet Verwendung als Rodentizid. Diese Verwendung ist heute aufgrund der strengeren Sprengstoffgesetze nicht mehr gebräuchlich.
Sicherheitshinweise
Hexogen ist ein hochexplosiver Stoff. Oberhalb seines Schmelzpunktes von 200 °C zersetzt es sich unter Bildung von Stickstoffoxiden. Zusammen mit Quecksilberfulminat als klassischem Initialzünder besteht Explosionsgefahr.

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 25.11. 2022