
Cystin
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Toxikologische Daten | 25000 mg/kg (LD50, Ratte, oral) | ||||||||
Cystin ist eine chemische Verbindung. Es handelt sich um ein Disulfid, das aus zwei Molekülen der proteinogenen α-Aminosäure Cystein durch Oxidation ihrer Sulfhydrylgruppen (–SH) entsteht.
| Strukturformel | |
|---|---|
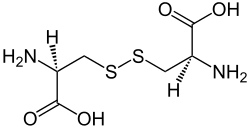
| |
| Strukturformel von (natürlichem) L-(−)-Cystin | |
| Allgemeines | |
| Name | Cystin |
| Andere Namen | |
| Summenformel | C6H12N2O4S2 |
| Kurzbeschreibung | weißes Pulver mit schwachem Eigengeruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 56-89-3 (L-Cystin) |
| ECHA-InfoCard | 100.000.270 |
| PubChem | 67678 |
| ChemSpider | 60997 |
| DrugBank | DB00138 |
| Arzneistoffangaben | |
| ATC-Code | V06DD |
| Wirkstoffklasse | Aminosäure |
| Eigenschaften | |
| Molare Masse | 240,30 g/mol |
| Aggregatzustand | fest |
| Dichte | 1,667 g/cm3 |
| Schmelzpunkt | 260–261 °C (Zersetzung) |
| pKS-Wert | 1 |
| Löslichkeit | sehr schlecht in Wasser (190 mg/l> bei 20 °C) |
L-Cystin [Synonym: (R,R)-Cystin] ist das natürlich vorkommende Enantiomer. Gemeinhin ist L-Cystin gemeint, wenn der Ausdruck Cystin ohne Deskriptor gebraucht wird.
Entdeckung und natürliches Vorkommen

Das natürlich vorkommende Cystin wurde 1810 von William Hyde Wollaston als „cystic oxide“ in Blasensteinen entdeckt, erst 74 Jahre später das monomere Cystein. Die schwefelhaltige Aminosäure findet sich in hoher Konzentration peptidisch gebunden auch in den Zellen des Immunsystems, der Haut und insbesondere den Haaren.
So enthalten Keratine, die Faserproteine der Hornsubstanz, von Haaren, Borsten oder Federn etwa 11 % L-Cystin. Es entsteht durch Ausbildung von Disulfidbrücken zwischen L-Cystein-Seitenketten in verschiedenen Proteinabschnitten. Je stärker ihre Faserkomponenten damit quervernetzt werden, desto steifer werden die Keratinfasern. Das gebundene Cystin wird hier aus den im Polypeptid gebundenen Cystein-Bausteinen gebildet, nicht durch Einbau von freiem Cystin.
Daneben kommen auch Nierensteine vor, die aus L-Cystin bestehen.
Es besteht keine nähere Verwandtschaft zu den giftigen Microcystinen (außer dass diese als cyclische Oligopeptide aus Aminosäuren aufgebaut sind).
Isomerie
Cystin ist chiral, da es zwei Stereozentren enthält. Nur ein Enantiomer, das L-Cystin [Synonym: (R,R)-Cystin], kommt natürlich vor. Dessen Spiegelbild, D-Cystin [Synonym: (S,S)-Cystin], besitzt ebenso wie das dritte Stereoisomer, das meso-Cystin, keine praktische Bedeutung.
| Isomere von Cystin | |||
| Name | L-Cystin | D-Cystin | meso-Cystin |
| Andere Namen | (R,R)-Cystin (−)-Cystin |
(S,S)-Cystin (+)-Cystin |
(R,S)-Cystin (S,R)-Cystin |
| Strukturformel | -Cystine_Structural_Formula_V1.svg.png)
|
-Cystine_Structural_Formula_V1.svg.png)
|
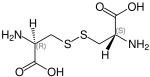
|
| CAS-Nummer | 56-89-3 | 349-46-2 | 6020-39-9 |
| 923-32-0 (DL) | |||
| EG-Nummer | 200-296-3 | 206-486-2 | |
| 213-094-5 (DL) | |||
| ECHA-Infocard | 100.000.270 | 100.005.897 | |
| 100.011.904 (DL) | |||
| PubChem | 67678 | 6857538 | 6991966 |
| 595 (DL) | |||
| FL-Nummer | 17.006 | - | - |
Herstellung und Gewinnung
Meist wird L-Cystin für die Verwendung in der Lebensmittelindustrie heute fermentativ hergestellt. Hierbei kommen genetisch modifizierte Bakterien vom Typ Escherichia coli zum Einsatz. Das von den Mikroorganismen gebildete L-Cystin kann anschließend aufgereinigt und kristallisiert werden. Da lediglich die Bakterienstämme, nicht aber deren Nährsubstrat gentechnisch modifiziert wurden und keine modifizierte DNA mehr im Produkt verbleibt, wird das gewonnene L-Cystin nicht als gentechnisch verändert eingestuft.
Ein zweiter Herstellungsprozess ist die saure Hydrolyse keratinhaltiger Proteine, wie Geflügelfedern, Haare und Hufe. Hierbei erhält man nach der Neutralisation ein Proteinhydrolysat, das aus den etwa 20 proteinogenen α-Aminosäuren besteht. Daraus lässt sich eine L-Cystin- und L-Tyrosin-reiche Fraktion leicht durch Abtrennung der gut wasserlöslichen Aminosäuren gewinnen, da L-Cystin- und L-Tyrosin sich nur wenig in Wasser lösen. Bis heute wird L-Cystin nach dieser einfachen Trennmethode kommerziell gewonnen.
Verwendung
Die elektrochemische Reduktion von L-Cystin (ein Disulfid) liefert L-Cystein (ein Thiol). Aus L-Cystin werden zahlreiche Arzneistoffe im industriellen Maßstab hergestellt, z.B. (R)-S-Carboxymethylcystein und (R)-N-Acetylcystein.
Cystin kann (ebenso wie Cystein, E920) in der Mehl-Behandlung eingesetzt werden. Beide Aminosäuren verändern die Eigenschaften des Klebers in Weizenmehlteigen. Während Cystin die Kleberstruktur festigt, die Teige also weniger dehnbar macht, lockert Cystein die Kleberstruktur und macht die Teige dadurch dehnbarer.
Bedeutung im Friseurhandwerk
Die reversible Umwandlung von Cystin in Cystein und zurück ist Grundlage des im Friseurhandwerk als „Dauerwelle“ bekannten Verfahrens, glattes Haar durch chemische Behandlung des Haarkeratins in gewelltes zu überführen. Durch Reduktion mit Thioglykolsäure werden dabei die für die mechanische Festigkeit der Haare verantwortlichen Cystinbindungen im Haarkeratin aufgebrochen, woraufhin das so erweichte Haar mittels Lockenwickler in die gewünschte Form gebracht werden kann. Durch anschließende Oxidation mit Wasserstoffperoxid werden schließlich die für die Stabilität sorgenden Disulfidbindungen des Haars aus den reduzierten Sulfhydrylgruppen wiederhergestellt, so dass das Haar auch nach Entfernung der Lockenwickler seine vorgegebene Form beibehält. Umgekehrt kann dieses Verfahren aber auch zur chemischen Haarglättung mit Hilfe sogenannter „Relaxer“ eingesetzt werden.
Handelsnamen
- Kombinationspräparate
Pantogar (A), Pantovigar (D), Priorin (A, D)


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 22.10. 2024