
Mangan(II)-sulfat
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | 0,5 mg/m3[2] | ||||||||
Mangan(II)-sulfat ist das zweiwertige Mangansalz der Schwefelsäure mit der Summenformel MnSO4. Mangan(II)-sulfat bildet im kristallwasserhaltigen Zustand blassrosa monokline, im wasserfreien Zustand weiße Kristalle.
| Strukturformel | ||
|---|---|---|
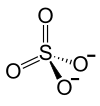
| ||
| Allgemeines | ||
| Name | Mangan(II)-sulfat | |
| Andere Namen | ||
| Summenformel | MnSO4 | |
| Kurzbeschreibung | weißer, kristalliner Feststoff[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer |
| |
| EG-Nummer | 232-089-9 | |
| ECHA-InfoCard | | |
| PubChem | | |
| ChemSpider | | |
| Eigenschaften | ||
| Molare Masse |
| |
| Aggregatzustand | fest | |
| Dichte | ||
| Schmelzpunkt | ||
| Löslichkeit | ||
Vorkommen
In der Natur kommt Mangan(II)-sulfat als das Mineral Mallardit vor (MnSO4 · 7 H2O).[4]
Gewinnung und Darstellung
Mangan(II)-sulfat kann durch Auflösen von Mangan(II)-carbonat in Schwefelsäure dargestellt werden.
Eigenschaften
-sulfate-photo.jpg)
Mangan(II)-sulfat ist gut löslich in Wasser, aber unlöslich in Alkoholen. Es bildet mehrere Hydrate (Monohydrat, Tetrahydrat, Heptahydrat). Die wasserfreie Substanz erhält man durch Abrauchen der meisten Manganverbindungen mit Schwefelsäure.
Verwendung
Mangan(II)-sulfat findet Verwendung als Zusatzstoff in Tiernahrung, in der Landwirtschaft, der Zeugdruckerei, Porzellanfabrikation, zur Desinfektion, in der Färberei und in der Holzbeize.
Einzelnachweise
- ↑ Eintrag zu
 MANGANESE SULFATE in der CosIng-Datenbank.
MANGANESE SULFATE in der CosIng-Datenbank.
- ↑ Hochspringen nach: a b
c d e
f g h
i j k
Eintrag zu
 Mangan(II)-sulfat in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Mangan(II)-sulfat in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Eintrag zu
 Manganese sulphate im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Manganese sulphate im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ Mineralienatlas:
 Mallardit
Mallardit


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 23.11. 2024


