Calciumphosphat
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Toxikologische Daten | > 5000 mg/kg (LD50, Ratte, oral) | ||||||||
Calciumphosphat, Tricalciumorthophosphat oder Tricalciumphosphat (Ca3(PO4)2) ist ein Calciumsalz der ortho-Phosphorsäure und gehört zu den Phosphaten. Der Begriff Tricalciumphosphat wird gelegentlich für die sehr ähnliche Verbindung Pentacalciumhydroxytriphosphat (Ca5(PO4)3·OH) verwendet.
Vorkommen
In der Natur kommt Calciumphosphat nicht in reiner Form vor. Calciumphosphatminerale wie Apatit oder Whitlockit enthalten stets weitere Kationen (z.B. Natrium, Magnesium oder Eisen) und Anionen (Hydroxid, Carbonat, Fluorid oder Chlorid). Das mit Abstand häufigste und wirtschaftlich bedeutendste Calciumphosphatmineral ist Apatit. Abiogener Apatit ist akzessorischer Bestandteil zahlreicher magmatischer Gesteine und Hauptbestandteil des marin gebildeten Gesteins Phosphorit. Mehr als 80 % der weltweiten Förderung von Apatit entstammen Phosphoritlagerstätten.
| Strukturformel | |
|---|---|
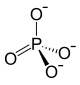 | |
| Allgemeines | |
| Name | Calciumphosphat |
| Andere Namen |
|
| Summenformel | Ca3(PO4)2 |
| CAS-Nummer | 7758-87-4 |
| PubChem | 24456 |
| ATC-Code | A12AA01 |
| Kurzbeschreibung | weißer, geruchloser Feststoff |
| Eigenschaften | |
| Molare Masse | 310,18 g/mol |
| Aggregatzustand | fest |
| Dichte | 3,14 g/cm3 |
| Schmelzpunkt | 1670 °C |
| Löslichkeit | praktisch unlöslich in Wasser (0,02 g/l |
Apatit wird aber auch von bzw. in Lebewesen gebildet: Die mineralische Substanz der Knochen und Zähne der Wirbeltiere besteht daher überwiegend aus Calciumphosphat. In Elfenbein liegt der Gesamtanteil bei 55 bis 61 %. Außerdem enthält Guano, ein biogenes „Sediment“ aus Tierexkrementen, geringe Mengen an Apatit. Biogenes Calciumphosphat ist eine wichtige Phosphatquelle für die sogenannte Phosphogenese, einen Teilschritt bei der Entstehung von Phosphoriten.
Eigenschaften
Calciumphosphat ist ein weißer und geruchloser Feststoff, der bei 1670 °C schmilzt. Es ist praktisch unlöslich in Wasser.
Verwendung
Das (wasserunlösliche) tertiäre Calciumphosphat wird zur Herstellung des (wasserlöslichen) primären Calciumphosphats Ca(H2PO4)2 verwendet, eines weit verbreiteten Düngemittels, besser bekannt als Superphosphat.
Calciumphosphat dient auch zur Herstellung von Phosphorsäure, indem man es mit Schwefelsäure reagieren lässt:

In der Lebensmitteltechnik wird Calciumphosphat als Säureregulator, Festigungsmittel oder Trennmittel eingesetzt; zum Beispiel für Fertigkuchenmischungen, bei denen es als Rieselhilfe ein Klumpen verhindern und die Rieselfähigkeit erhalten soll. Calciumphosphat ist zusammen mit Calciumdihydrogenphosphat in der EU als Lebensmittelzusatzstoff unter der gemeinsamen Nummer E 341 („Calciumphosphate“) für bestimmte Lebensmittel mit jeweils unterschiedlichen Höchstmengenbeschränkungen auch für Öko-Lebensmittel zugelassen. Nach der Zusatzstoff-Zulassungsverordnung sind dies – für die meisten zugelassenen Phosphate weitgehend einheitliche – einzelne Festlegungen für eine breite Palette mit zahlreichen unterschiedlichen Lebensmittelsorten. Die zugelassenen Höchstmengen variieren von 0,5 bis hin zu 50 Gramm pro Kilogramm (in Getränkeweißer für Automaten) oder auch dem Fehlen einer festen Beschränkung (quantum satis – nach Bedarf, bei Nahrungsergänzungsmitteln und teils bei Kaugummis). Phosphor steht im Verdacht Hyperaktivität, allergische Reaktionen und Osteoporose auszulösen. Es wurde eine erlaubte Tagesdosis von 70 Milligramm pro Kilogramm Körpergewicht für die Gesamtmenge aufgenommener Phosphorsäure und Phosphate festgelegt.
In der Knochenchirurgie und Implantologie wird Tricalciumphosphat als synthetisches Knochenersatzmaterial eingesetzt; es wird langsam resorbiert und durch Eigenknochen ersetzt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.01. 2025