Kaliumhydroxid
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | Schweiz: 2 mg/m3 (gemessen als einatembarer Staub) | |||||||
Kaliumhydroxid (auch Ätzkali, kaustisches Kali), chemische Formel KOH, ist ein weißer hygroskopischer Feststoff. In Wasser löst es sich unter großer Wärmeentwicklung zu der starken Base Kalilauge. Mit Kohlendioxid der Luft reagiert es zu Kaliumcarbonat und wird deshalb in luftdichten Behältern aufbewahrt. Um zu verhindern, dass Kaliumhydroxid Wasser aus der Luft bindet, kann man es mit einem Trockenmittel lagern. Das Hydroxid-Ion verdrängt als starke Base schwächere und flüchtige Basen aus ihren Salzen.
| Kristallstruktur | ||
|---|---|---|
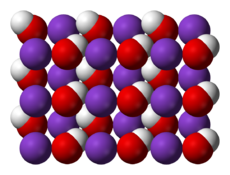 | ||
| __ K+ __ OH− | ||
| Allgemeines | ||
| Name | Kaliumhydroxid | |
| Andere Namen |
| |
| Verhältnisformel | KOH | |
| Kurzbeschreibung | weißer, hygroskopischer Stoff | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 215-181-3 | |
| ECHA-InfoCard | | |
| PubChem | | |
| DrugBank | | |
| Eigenschaften | ||
| Molare Masse | 56,11 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 2,04 g/cm3 | |
| Schmelzpunkt | 360 °C | |
| Siedepunkt | 1320 °C | |
| Löslichkeit | gut in Wasser (1120 g/l bei 20 °C) und in 2,5 Teilen Alkohol (Ethanol) | |
Eigenschaften

Kaliumhydroxid ist ein weißer, stark hygroskopischer Stoff, der meist als Plätzchen oder Stangen, seltener als Pulver verkauft wird. In Wasser löst es sich unter großer Wärmeentwicklung durch die negative Lösungsenthalpie von -57,1 kJ/mol und bildet Kalilauge, im festen Zustand bildet es Mono-, Di- und Tetrahydrate. Mit dem in der Luft enthaltenen Kohlendioxidreagiert es unter Bildung von Kaliumcarbonat.
Synthese
Früher wurde Kaliumhydroxid durch so genannte "Kaustifizierung" von Kaliumcarbonat hergestellt. Dies verläuft nach der Gleichung
Heute wird Kaliumhydroxid meist durch wässrige Elektrolyse von Kaliumchlorid und anschließendem Eindampfen der Lösung gewonnen.
Verwendung
Kaliumhydroxid wird in der Waschmittelfabrikation zur Herstellung weicher Seifen (Schmierseifen) und zur Herstellung wasserenthärtenden Kaliumphosphats für flüssige Waschmittel benutzt.
In der Mikrosystemtechnik (MST) wird KOH zum selektiven anisotropen Ätzen von einkristallinem Silicium eingesetzt.
In der Mikrobiologie wird KOH zur Unterscheidung von grampositiven und gramnegativen Bakterien im Schnelltestverfahren verwendet.
In galvanischen Sauerstoffsensoren wird es als Elektrolyt verwendet. Denselben Zweck erfüllt es auch in den weit verbreiteten Alkali-Mangan-Zellen.
In der Lebensmittelindustrie wird KOH als Säureregulator eingesetzt. Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 525 ohne Höchstmengenbeschränkung (quantum satis) für Lebensmittel allgemein zugelassen.
KOH wird zur Herstellung von Kaliumverbindungen, Glas, Farbstoffen, Batterien sowie als Trocknungs- und Absorptionsmittel von (quantum satis) für Lebensmittel allgemein zugelassen.
KOH wird zur Herstellung von Kaliumverbindungen, Glas, Farbstoffen, Batterien sowie als Trocknungs- und Absorptionsmittel von Kohlenstoffdioxid verwendet.
KOH kann unter starker Erwärmung bestimmte Metalle alkalisch-oxidativ aufschließen.
Bei der Herstellung durch Umesterung von Rapsöl und Methanol zu Biodiesel wird Kalilauge als Katalysator eingesetzt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den : 03.11. 2023