
Monosilan
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK |
Schweiz: 0,5 ml/m3 bzw. 0,7 mg/m3 | |||||||
Monosilan ist der einfachste Vertreter der Silane (auch Siliciumwasserstoffe genannt) und somit das Siliciumanalogon von Methan, CH4. Es hat – im Gegensatz zu Methan – einen unangenehmen repulsiven Geruch.
| Strukturformel | |
|---|---|
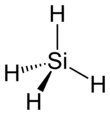 | |
| Allgemeines | |
| Name | Monosilan |
| Andere Namen |
|
| Summenformel | SiH4 |
| Kurzbeschreibung | farbloses Gas mit unangenehmem Geruch |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 7803-62-5 |
| EG-Nummer | 232-263-4 |
| ECHA-InfoCard | 100.029.331 |
| PubChem | 23953 |
| Eigenschaften | |
| Molare Masse | 32,12 g/mol |
| Aggregatzustand | gasförmig |
| Dichte | 1,44 g/l (1013 hPa, 0 °C) |
| Schmelzpunkt | −185 °C |
| Siedepunkt | −112 °C |
| Löslichkeit | rasche Hydrolyse in Wasser |
Herstellung
Monosilan kann im Labor durch Reaktion von Magnesiumsilicid mit Salzsäure hergestellt werden. Technische Herstellungsverfahren beruhen auf der Hydrierung von Siliciumtetrachlorid mit Lithiumhydrid im Lithiumchlorid/Kaliumchlorid-Eutektikum,
bzw. auf der Dismutation von Hydrogenchlorsilanen, wie z.B. Trichlorsilan.
Chemische Eigenschaften
Monosilan ist hoch entzündlich und pyrophor, d.h., Monosilan entzündet sich an der Luft selbst. Austretendes Monosilan kann nicht gelöscht werden. Bei der Verbrennung entstehen Siliciumdioxid und Wasserdampf.
In Wasser bei einem pH-Wert oberhalb von 7 zersetzen sich Silane zu Kieselsäure und Wasserstoff:
- Monosilan und Wasser bilden Kieselsäure und Wasserstoff.
Unter Luft- und Feuchtigkeitsausschluss ist Monosilan bis ca. 300 °C stabil. Darüber tritt Zerfall in Silicium und Wasserstoff ein.
Durch Einwirkung von Halogenen oder Halogenwasserstoff in Gegenwart von Aluminiumchlorid lassen sich die Wasserstoffatome der Reihe nach ersetzen.
Bei der Umsetzung von Monosilan mit Alkalimetallen z.B. in Ethylenglycoldimethylether bilden sich die Silylverbindungen der entsprechenden Metalle:
Die UN-Nummer von Monosilan ist 2203, der Gefahrzettel 2.1.
Verwendung
Monosilan wird zur Abscheidung von Silicium-, Siliciumoxid- und Siliciumnitridschichten verwendet. Daher wird Monosilan hauptsächlich in der Halbleiterfertigung oder bei der Herstellung von Solarzellen eingesetzt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.02. 2024

