Lithiumchlorid
| Sicherheitshinweise | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||
| Toxikologische Daten | 526 mg·kg−1 (LD50, Ratte, oral) | ||||||||||||||
Lithiumchlorid LiCl, das Lithiumsalz der Chlorwasserstoffsäure, bildet farblose, stark hygroskopische Kristalle. Neben dem wasserfreien Lithiumchlorid existieren noch verschiedene Hydrate, bekannt sind LiCl · n H2O mit n=1, 3 und 5.
| Kristallstruktur | |
|---|---|
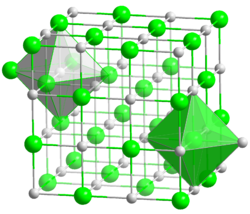 | |
| __ Li+ __ Cl− | |
| Kristallsystem | kubisch |
| Raumgruppe | Fm3m (Nr. 225) |
| Koordinationszahlen | Li[6], Cl[6] |
| Allgemeines | |
| Name | Lithiumchlorid |
| Verhältnisformel | LiCl |
| CAS-Nummer |
|
| PubChem | 433294 |
| ECHA-InfoCard | 100.028.375 |
| Kurzbeschreibung | weißer Feststoff |
| Eigenschaften | |
| Molare Masse | 42,39 g/mol |
| Aggregatzustand | fest |
| Dichte | 2,07 g/cm3 |
| Schmelzpunkt | 614 °C (wasserfrei) |
| Siedepunkt | 1360 °C |
| Löslichkeit |
|
| Brechungsindex | 1,662 |
Eigenschaften
Lithiumchloridlösungen sind stark hygroskopisch. Sie reduzieren den Wasserdampfdruck um ca. 90 %. Aus konzentrierten wässrigen Lösungen kristallisiert wasserfreies Lithiumchlorid erst bei Temperaturen oberhalb von 98 °C aus. Bei niedrigeren Temperaturen erhält man eine der Hydratformen. Die Löslichkeit in Wasser beträgt ca. 450 g LiCl/kg Lösung. Gasförmiges Lithiumchlorid bildet planare Ringe aus mehreren Lithiumchloridmolekülen (Di-, Tri- und Oligomere).
Lithiumchloridlösungen sind sehr korrosiv. Zur Handhabung konzentrierter Lösungen sind geeignete Werkstoffe auszuwählen. Lithiumchloridlösungen schädigen auch Beton.
Die Standardbildungsenthalpie des kristallinen Lithiumchlorids beträgt ΔfH0298 = −408,27 kJ/mol.
Darstellung
Die Gewinnung von Lithiumchlorid erfolgt durch Umsetzung einer wässrigen Lithiumhydroxid - oder Lithiumcarbonatlösung mit Chlorwasserstoff und anschließender Aufkonzentrierung und Trocknung.
Technisch relevant ist zurzeit nur die Umsetzung von Lithiumcarbonat mit Salzsäure mit anschließender Einengung unter Kristallisation von Lithiumchlorid in Vakuumverdampfern.
Außerdem fällt Lithiumchlorid häufig bei metallorganischen Synthesen als Nebenprodukt an (Salzmetathese).
Verwendung
Lithiumchlorid kann zur Herstellung von Lithium benutzt werden. Hierzu wird eine Mischung aus Lithiumchlorid und Kaliumchlorid in einer Schmelzflusselektrolyse eingesetzt. Wegen der stark hygroskopischen Wirkung kann es als Trocknungsmittel und auch zur Raumentfeuchtung verwendet werden. Des Weiteren kann es als Flussmittel in der Löt- und Schweißtechnik eingesetzt werden. Auf Grund seiner Hygroskopie kann es in Taupunktsensoren oder -hygrometern verwendet werden. Die elektrische Leitfähigkeit des Salzes ist stark abhängig von der Wasserkonzentration, weshalb die Umgebungsfeuchte aus der Leitfähigkeit des Lithiumchlorids bestimmt werden kann. In chemischen oder geologischen Untersuchungen kann Lithiumchlorid als Tracer eingesetzt werden. Lithiumchlorid kann in Enteiserlösungen verwendet werden. Da diese jedoch korrosiv sind, sind sie beispielsweise zur Anwendung an Fluggeräten in den USA verboten. Auch die Textilindustrie verwendet Lithiumchlorid. In Kältebädern können Lithiumchloridlösungen mit 25–30 % LiCl zum Einsatz kommen. Solche Kältebäder können bis −70 °C flüssig bleiben.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.03. 2022

