
Natriumphosphat
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
Natriumphosphat ist ein Natriumsalz der Phosphorsäure. Es besteht aus Natrium- (3 Na+) und Phosphationen (PO43−).
| Strukturformel | ||
|---|---|---|
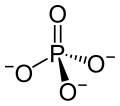
| ||
| Allgemeines | ||
| Name | Natriumphosphat | |
| Andere Namen | ||
| Summenformel | Na3PO4 | |
| Kurzbeschreibung | weißer geruchloser Feststoff[3] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer |
|
|
| ECHA-InfoCard | | |
| PubChem | | |
| Arzneistoffangaben | ||
| ATC-Code | | |
| Eigenschaften | ||
| Molare Masse |
| |
| Aggregatzustand | fest | |
| Dichte | 1,62 g/cm3 (Dodecahydrat)[3] | |
| Schmelzpunkt | ||
| pKS-Wert | pKb: 1,64[4] | |
| Löslichkeit | leicht in Wasser (285 g·/l bei 20 °C, Dodecahydrat)[3] | |

Gewinnung und Darstellung
Hergestellt werden kann Natriumphosphat durch die Neutralisation von Phosphorsäure mit Natriumhydroxid. Dies muss nicht zwingend in wässrigem Medium geschehen.
Eigenschaften
Natriumphosphat bildet farblose Kristalle aus. Natriumphosphat reagiert in wässriger Lösung basisch, da das basische Phosphation protoniert wird. Der pH-Wert einer zehnprozentigen Lösung beträgt 11,8-12,2.
Die Verbindung tritt in mehreren Modifikationen auf, so eine tetragonale [α], orthorhombische [β] und orthorhombische (pseudokubische) [γ] Form. Die α-Form entsteht unter 600 °C (a = 10,757 und c = 6,824 Å). Die γ-Form entsteht zwischen 700 °C und 800 °C (a = 5,237, b = 5,203 und c = 7,400 Å) und besitzt eine Kristallstruktur mit der Raumgruppe Pnma (Raumgruppen-Nr. 62). Die bisher nicht charakterisierte β-Form scheint ein Zwischenprodukt bei den α → γ- und γ → α-Änderungen zu sein und wurde immer im Gemisch mit der α- oder γ-Form erhalten. Ihre Struktur ist eng mit der von β-Natriumarsenat Na3AsO4 verwandt.[5] Die Wärmeleitfähigkeit bei 300 K beträgt 0,8 W·m−1·K−1.[6]
Verwendung
Phosphate werden als Zusatz in Waschmitteln verwendet. Sie sind in der Lage, durch Komplexbildung mit mehrwertigen Metallionen (Mg2+ etc.) die Wasserhärte herabzusetzen. Ihr Einsatz ist heute in einigen Ländern (unter anderem in der Schweiz) verboten. Unter der Bezeichnung „Trinatriumphosphat“ wird Natriumphosphat im Betrieb von Dampfkesseln und Heizwasserkreisläufen als Dosierlösung eingesetzt, um das Inhaltswasser zu enthärten und gleichzeitig zu alkalisieren (Korrosionsschutz). Es wird hierzu eine drei- bis fünfprozentige Lösung (3–5 kg/100 l) in einem Dosierbehälter angesetzt. Die Dosierung erfolgt zweckmäßigerweise mittels einer Dosierpumpe in den Speisewasserbehälter, im Bedarfsfall in den Kondensatbehälter. Die Zugabemenge für Füllwasser in Heizungsanlagen richtet sich nach der Härte und der Füllwassermenge. Für 1 m³ Füllwasser bei 0,18 mol/m³ = 1° dH werden 68 Gramm Trinatriumphosphat zugegeben.
Beispiel:
- Nachfüllmenge eines Heizungssystems: 0,8 m³
- Füllwasser - GH 2,14 mol/m³ = 12 °dH
- Menge Trinatriumphosphat = Nachfüllmenge [m³] mal [°dGH] mal 68 [g] = 0,8 × 12 mal 68
- Zugabemenge Trinatriumphosphat = 650 g
Die Zugabe erfolgt zweckmäßigerweise in den Heizungsrücklauf mittels Dosierpumpe oder Chemikalien-Einziehschleuse.
In der Lebensmitteltechnik wird Natriumphosphat als Komplexbildner, Säureregulator, Schmelzsalz oder Festigungsmittel eingesetzt. Es ist zusammen mit Natriumdihydrogenphosphat und Dinatriumhydrogenphosphat in der EU als Lebensmittelzusatzstoff unter der gemeinsamen Nummer E 339 („Natriumphosphate“) für bestimmte Lebensmittel mit jeweils unterschiedlichen Höchstmengenbeschränkungen zugelassen. Nach der Zusatzstoff-Zulassungsverordnung sind dies – für die meisten zugelassenen Phosphate weitgehend einheitliche – einzelne Festlegungen für eine breite Palette mit zahlreichen unterschiedlichen Lebensmittelsorten. Die zugelassenen Höchstmengen variieren von 0,5 bis hin zu 50 Gramm pro Kilogramm (in Getränkeweißer für Automaten) oder auch dem Fehlen einer festen Beschränkung (quantum satis – nach Bedarf, bei Nahrungsergänzungsmitteln und teils bei Kaugummis).
Phosphate werden auch als Kunstdünger eingesetzt.
Das radioaktive 32Phosphor wird als Natriumphosphat (oder Dihydrogenphosphat) zur nuklearmedizinischen Therapie bei Polycythaemia vera eingesetzt (Radiophosphortherapie).
Biologische Bedeutung
Die Folge des Einsatzes von Phosphaten in Waschmitteln ist ein größeres Nährstoffangebot in Gewässern (Eutrophierung). Daraus resultiert ein verstärktes Algenwachstum, was zum Umkippen eines Gewässers führen kann.
Einzelnachweise
- ↑ Eintrag zu
 E 339: Sodium phosphates
in der Europäischen Datenbank für Lebensmittelzusatzstoffe.
E 339: Sodium phosphates
in der Europäischen Datenbank für Lebensmittelzusatzstoffe.
- ↑ Eintrag zu
 TRISODIUM PHOSPHATE in der
CosIng-Datenbank der EU-Kommission.
TRISODIUM PHOSPHATE in der
CosIng-Datenbank der EU-Kommission.
- ↑ Hochspringen nach: a b
c d e
f g h Eintrag zu
 Trinatriumphosphat in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen
Unfallversicherung. (JavaScript erforderlich)
Trinatriumphosphat in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen
Unfallversicherung. (JavaScript erforderlich)
- ↑ Eintrag zu Phosphorsäure. In: Römpp Online. Georg Thieme Verlag.
- ↑ M. Kizilyalli, A.J.E. Welch:
Preparation and X-ray powder diffraction data for anhydrous sodium orthophosphates. In: Journal of Inorganic and Nuclear Chemistry. 38, 1976, S. 1237,
doi:
 10.1016/0022-1902(76)80127-3.
10.1016/0022-1902(76)80127-3.
- ↑ Bashir M Suleiman and Arnold Lundén: Thermal conductivity and diffusivity of
sodiumorthophosphate. In: J. Phys.: Condens. Matter.
Band 15, Nr. 41, 2003,
S. 6911–6918,
doi:
 10.1088/0953-8984/15/41/001.
10.1088/0953-8984/15/41/001.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025
