Osmium(VIII)-oxid
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | Schweiz: 0,2 μl/m3 bzw. 2 μg/m3 (berechnet als Osmium)[3] | |||||||
| Toxikologische Daten | 15 mg/kg (LD50, Ratte, oral) | |||||||
Osmium(VIII)-oxid (auch: Osmiumsäure) ist das Oxid des Elementes Osmium in seinem höchsten Oxidationszustand (+8).
| Kristallstruktur | ||
|---|---|---|
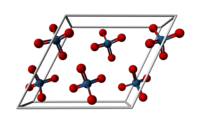
| ||
| _ Os8+ _ O2− | ||
| Kristallsystem | monoklin | |
| Raumgruppe | C2/c (Nr. 15) | |
| Gitterparameter | a = 938 pm, b = 452 pm, c = 863 pm, β = 116,58° | |
| Allgemeines | ||
| Name | Osmium(VIII)-oxid | |
| Andere Namen |
| |
| Verhältnisformel | OsO4 | |
| Kurzbeschreibung | farblose, monokline Nadeln mit stechendem Geruch | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 244-058-7 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Eigenschaften | ||
| Molare Masse | 254,23 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 4,91 g/cm3 | |
| Schmelzpunkt | 40 °C | |
| Siedepunkt | 130 °C | |
| Dampfdruck | 10 hPa (20 °C) | |
| Löslichkeit |
| |
| Thermodynamische Eigenschaften | ||
| ΔHf0 |
−386 kJ·mol−1[4] | |
Darstellung und Gewinnung
Osmium(VIII)-oxid wird durch Oxidation aus Osmium oder von Osmiumlösungen mit Salpetersäure oder Natriumperoxodisulfat in Schwefelsäure hergestellt. Wegen seiner Flüchtigkeit und Giftigkeit kommt es in Ampullen eingeschmolzen in den Handel.

Eigenschaften
Physikalische Eigenschaften
Osmium(VIII)-oxid bildet blassgelbe Kristalle mit einem sehr niedrigen Schmelzpunkt von 40 °C und einem Siedepunkt von 130 °C. Diese Verbindung besitzt einen durchdringenden ozonähnlichen Geruch (altgriechisch ὀσμή osmē „Geruch, Gestank“), was die Namensgebung für das Metall Osmium erklärt. Osmium(VIII)-oxid besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15). Die Gitterparameter sind a = 938 pm, b = 452 pm, c = 863 pm und β = 116,58°.[5] Es löst sich nur mäßig in Wasser, jedoch sehr gut in Tetrachlorkohlenstoff CCl4.
Chemische Eigenschaften
Osmium(VIII)-oxid ist ein starkes Oxidationsmittel und reagiert mit reduzierenden und brennbaren Stoffen. Es wird leicht durch organische Verbindungen zu schwarzem Osmium(IV)-oxid reduziert.
Verwendung
In der organischen Synthese kann es verwendet werden, um Alkene zu Diolen zu oxidieren (Dihydroxylierung). Dabei entsteht stereoselektiv ein Diol mit cis-ständigen OH-Gruppen. Da das Reagens sehr teuer und giftig ist, wurden die Reaktionsbedingungen inzwischen so verbessert, dass Osmium(VIII)-oxid nur in kleinen Mengen als Katalysator erforderlich ist, während Wasserstoffperoxid oder N-Methylmorpholin-N-oxid als Oxidationsmittel wirken.[6]
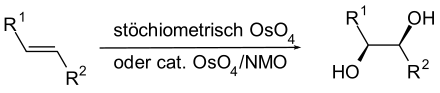
Für die Transmissionselektronenmikroskopie (TEM) wird typisch 1%ige[7] Osmiumtetroxidlösung zum Nachfixieren und Kontrastieren von Proben aus biologischem Material verwendet. Insbesondere Lipide werden dabei optisch schwarz angefärbt.
Sonstiges
Am 6. April 2004 berichtete die amerikanische Nachrichtenagentur ABC News, dass der britische Geheimdienst glaubte, einen Bombenanschlag unter Verwendung dieser Substanz vereitelt zu haben. Andere Quellen bezweifeln diese Darstellung, da Osmium(VIII)-oxid trotz seines hohen Schadenspotenzials für die Verwendung als Giftgas zu teuer sei.
Am 27. Mai 2011 ereignete sich ein Unfall an der Universitätsklinik Magdeburg: Eine Flasche mit 20–50 ml 2-%-Osmiumtetroxid-Lösung ging zu Bruch. Personen kamen dadurch nicht zu Schaden, das Haus 1 musste jedoch teilweise evakuiert werden. Die Feuerwehr reinigte den Unfallort.[0]
Literatur
- Daniela Pelclova: Osmium. In: Handbook on the Toxicology of Metals. Elsevier, 2022,
ISBN 978-0-12-822946-0, S. 639–647,
doi:
 10.1016/b978-0-12-822946-0.00023-4.
10.1016/b978-0-12-822946-0.00023-4.
Einzelnachweise
- ↑ Eintrag zu
 Osmium(VIII)-oxid in der
GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, (JavaScript erforderlich)
Osmium(VIII)-oxid in der
GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, (JavaScript erforderlich)
- ↑ Eintrag zu
 Osmium tetraoxide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA),
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Osmium tetraoxide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA),
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK-
und BAT-Werte (Suche nach 20816-12-0 bzw. Osmium(VIII)-oxid).
Grenzwerte – Aktuelle MAK-
und BAT-Werte (Suche nach 20816-12-0 bzw. Osmium(VIII)-oxid).
- ↑ A. F. Holleman, N. Wiberg: Anorganische Chemie. 103. Auflage. 2. Band: Nebengruppenelemente, Lanthanoide, Actinoide, Transactinoide. Walter de Gruyter, Berlin / Boston 2016, ISBN 978-3-11-049590-4, S. 1975
- ↑ B. Krebs, K. Hasse: Refinements of the crystal structures of KTcO4,
KReO4 and OsO4. Bond lengths in tetrahedral oxo-anions and oxides of d0 transition metals. In:
Acta Crystallographica Section B. Band 32,
1976, S. 1334–1337,
doi:
 10.1107/S056774087600530X.
10.1107/S056774087600530X.
- ↑ V. VanRheenen, D.Y. Cha, W.M. Hartley:
 Catalytic Osmium Tetroxide Oxidation of Olefins: cis-1,2-Cyclohexanediol In:
Organic Syntheses. 58, 1978, S. 43,
doi:
Catalytic Osmium Tetroxide Oxidation of Olefins: cis-1,2-Cyclohexanediol In:
Organic Syntheses. 58, 1978, S. 43,
doi: 10.15227/orgsyn.058.0043; Coll. Vol. 6, 1988, S. 342
(
10.15227/orgsyn.058.0043; Coll. Vol. 6, 1988, S. 342
( PDF).
PDF).
- ↑ Eva-Maria Rottmayr:
 Licht- und elektronenmikroskopische Untersuchungen der Tunika von
Cystodytes dellechiajei DELLA VALLE. Dissertation, München 2001, S. 28.
Licht- und elektronenmikroskopische Untersuchungen der Tunika von
Cystodytes dellechiajei DELLA VALLE. Dissertation, München 2001, S. 28.
- ↑ Uni Magdeburg (Hrsg.):
UMMD – intern. Fakultätsratsinfo. Nr. 5, 2011
(
 uni-magdeburg.de
[PDF; 763 kB]).
uni-magdeburg.de
[PDF; 763 kB]).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 26.05. 2024

