
Magnesiumnitrat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Toxikologische Daten | 5440 mg/kg (LD50, Ratte, oral)[4] | ||||||
Magnesiumnitrat ist das Magnesiumsalz der Salpetersäure. Es ist hygroskopisch („feuchtigkeitsanziehend“) und hat die Summenformel Mg(NO3)2.
| Strukturformel | ||
|---|---|---|
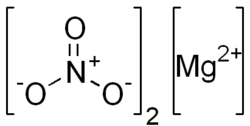
| ||
| Allgemeines | ||
| Name | Magnesiumnitrat | |
| Andere Namen | ||
| Summenformel | Mg(NO3)2 Mg(NO3)2 · 6 H2O | |
| Kurzbeschreibung | farb- und geruchloser Feststoff[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer |
| |
| EG-Nummer | 233-826-7 | |
| ECHA-InfoCard | | |
| PubChem | | |
| ChemSpider | | |
| Eigenschaften | ||
| Molare Masse | 148,3 g/mol 256,4 g/mol (Hexahydrat) | |
| Aggregatzustand | fest | |
| Dichte | 1,46 g/cm3 (Hexahydrat)[2] | |
| Schmelzpunkt | 89 °C (Hexahydrat)[2] | |
| Siedepunkt | ||
| Löslichkeit | ||
Vorkommen
Das Hexahydrat von Magnesiumnitrat kommt natürlich als Mineral Nitromagnesit vor.[3]
Herstellung
Magnesiumnitrat kann durch Reaktion von Magnesium mit Distickstofftetroxid in Ethylacetat gewonnen werden.[5]
Magnesiumnitrat entsteht durch die Neutralisation von Magnesiumhydroxid und Salpetersäure (siehe auch Titration, Synthese (Chemie)).
Ebenfalls möglich ist die Reaktion von Magnesium mit Salpetersäure oder durch Reaktion von Magnesiumhydroxid mit Ammoniumnitrat.[3]
Eigenschaften
Magnesiumnitrat ist ein farb- und geruchloser Feststoff, der gut löslich in Wasser ist.[4] Das Hexahydrat besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14). Bei 88,9 °C beginnt dieses sein Kristallwasser abzugeben und die Verbindung löst sich (schmilzt) in diesem.[3]
Verwendung
Magnesiumnitrat wird als Dünger, Latentwärmespeicher (als Hexahydrat) oder in der Keramikindustrie eingesetzt. Ferner ist es ein bauschädliches Salz und wird bei der Entwässerung von Salpetersäure verwendet (siehe auch Nitrate).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu
 MAGNESIUM NITRATE in der
CosIng-Datenbank der EU-Kommission, abgerufen am 20. Oktober 2025.
MAGNESIUM NITRATE in der
CosIng-Datenbank der EU-Kommission, abgerufen am 20. Oktober 2025.
- ↑ Hochspringen nach: a b c d
e f Datenblatt
 Magnesiumnitrat-Hexahydrat bei Merck, abgerufen am 20. Oktober 2025.
Magnesiumnitrat-Hexahydrat bei Merck, abgerufen am 20. Oktober 2025.
- ↑ Hochspringen nach: a b c
d Richard C. Ropp: Encyclopedia of the Alkaline Earth Compounds. Newnes, 2012, ISBN 0-444-59553-8, S. 217
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Hochspringen nach: a b c d Eintrag zu
 Magnesiumnitrat in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung,
abgerufen am 20. Oktober 2025. (JavaScript erforderlich)
Magnesiumnitrat in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung,
abgerufen am 20. Oktober 2025. (JavaScript erforderlich)
- ↑ Georg Brauer (Hrsg.), unter Mitarbeit von Marianne Baudler u. a. Handbuch der Präparativen Anorganischen Chemie. 3., umgearbeitete Auflage. Band II, Ferdinand Enke, Stuttgart 1978, ISBN 3-432-87813-3, S. 912.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 20.10. 2025
