Decalin
| Sicherheitshinweise | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||
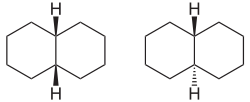
Decalin (auch Decahydronaphthalin, Perhydronaphthalin, Bicyclo[4.4.0]decan) ist eine farblose Flüssigkeit. Es wird durch katalytische Hydrierung von Naphthalin hergestellt und als Lösungsmittel (z.B. in Schuhcreme) verwendet. Je nach der Verknüpfungsgeometrie der beiden Cyclohexanringe gibt es zwei isomere Decaline, das cis-Decalin (Wasserstoffatome an den Brückenkopf-Kohlenstoffatomen stehen cis zueinander) und das trans-Decalin. Decalin ist ein bicyclisches Alkan und zählt zur übergeordneten Gruppe der Kohlenwasserstoffe.
Das technische Produkt ist üblicherweise ein Gemisch der Isomere.
| Strukturformel | ||
|---|---|---|
| ||
| cis-Decalin (links) und trans-Decalin (rechts) | ||
| Allgemeines | ||
| Name | Decalin | |
| Andere Namen |
| |
| Summenformel | C10H18 | |
| Kurzbeschreibung | farblose Flüssigkeit mit campher- oder mentholartigem Geruch | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 202-046-9 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| Eigenschaften | ||
| Molare Masse | 138,25 g/mol−1 | |
| Aggregatzustand | flüssig | |
| Dichte |
| |
| Schmelzpunkt |
| |
| Siedepunkt |
| |
| Dampfdruck | 1,3 hPa (20 °C, Isomerengemisch) | |
| Löslichkeit | nahezu unlöslich in Wasser (6 mg/l bei 25 °C) | |
| Brechungsindex |
| |
Eigenschaften
Physikalische und chemische Eigenschaften
Die farblose, schwer flüchtige Flüssigkeit hat einen campherartigen Geruch. Das technische Isomerengemisch schmilzt bei etwa −40 °C, siedet bei ungefähr 190 °C und ist brennbar. Die beiden Konfigurationsisomere weisen unterschiedliche physikalische Eigenschaften auf, so liegt der Schmelzpunkt des trans-Isomers bei −30 °C, der Siedepunkt bei 187 °C und die Dichte bei 0,8700 g/ml; das cis-Isomer schmilzt bei −43 °C, siedet bei 196 °C und hat die Dichte 0,8963 g/ml. Aufgrund des Siedepunktsunterschieds konnte Walter Hückel im Jahr 1925 die beiden Isomere durch sorgfältige Destillation voneinander trennen. Die trans-Form ist um 8,4 kJ/mol energieärmer als die cis-Form. In Wasser ist Decalin nahezu unlöslich, mit den meisten Kohlenwasserstoffen, Aceton und Benzol ist es mischbar.
Konformation
cis-Decalin besitzt zwei Sesselkonformere, die über einen Ring-Flip im Gleichgewicht vorliegen. In beiden Konformeren ist der zweite Sechsring auf der einen Seite axial und auf der anderen äquatorial gebunden, sodass beide Ring-Flip-Konformere stabil sind. Bei trans-Decalin ist im stabilen Sesselkonformer der zweite Sechsring über zwei äquatoriale Bindungen angebunden. Nach einem hypothetischen Ring-Flip lägen diese Bindungen axial vor. Diese Konformation wird nicht realisiert, da der zweite Sechsring dafür zu weit aufgeweitet werden müsste. trans-Decalin besitzt daher nur ein Sesselkonformer, während cis-Decalin in zwei zueinander enantiomeren Sesselkonformeren vorkommt, die sich bei Raumtemperatur schnell ineinander umwandeln und eine untrennbare Racemform darstellen.[3]
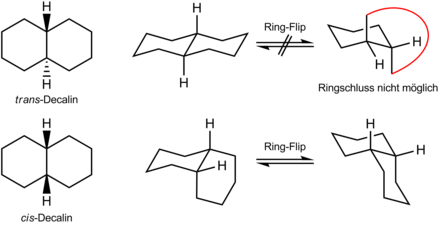
Die beiden Konformationsformen wurden von Ernst Mohr vorhergesagt und von Walter Hückel um 1925 bestätigt.
Sicherheitshinweise/Toxikologie
Decalin wirkt reizend auf Haut und Schleimhäute, wird leicht durch die Haut aufgenommen und ist stark wassergefährdend (WGK 3).
Decalin wurde 2012 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Decalin waren die Besorgnisse bezüglich hoher (aggregierter) Tonnage sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der PBT/vPvB-Stoffe. Die Neubewertung läuft seit 2012 und wird von Finnland durchgeführt.[4]
Einzelnachweise
- ↑ ↑ Eintrag zu
 Decalin in der GESTIS-Stoffdatenbank des
IFA. (JavaScript erforderlich)
Decalin in der GESTIS-Stoffdatenbank des
IFA. (JavaScript erforderlich)
- ↑ ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-134.
- ↑ Siegfried Hauptmann: Organische Chemie, 2. durchgesehene Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig, 1985, S. 107, ISBN 3-342-00280-8.
- ↑ Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): decahydronaphthalene,


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 19.08. 2024




