Kupfer(I)-chlorid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | 0,01 mg/m3 | ||||||||
| Toxikologische Daten | 140 mg/kg (LD50, Ratte, oral) | ||||||||
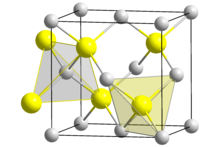
Kupfer(I)-chlorid ist eine chemische Verbindung aus Kupfer und Chlor mit der Formel CuCl. Sie ist eine Lewis-Säure. Kupfer(I)-chlorid kristallisiert in der Sphalerit-Struktur.
| Kristallstruktur | ||
|---|---|---|
| ||
| _ Cu+ _ Cl− | ||
| Allgemeines | ||
| Name | Kupfer(I)-chlorid | |
| Verhältnisformel | CuCl | |
| Kurzbeschreibung | weißes Kristallpulver | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 231-842-9 | |
| ECHA-InfoCard | ||
| PubChem | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 99,00 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 4,14 g/cm3 | |
| Schmelzpunkt | 430 °C | |
| Siedepunkt | 1490 °C (Zersetzung) | |
| Dampfdruck | 0,1 hPa (440 °C) | |
| Löslichkeit | ||
| Brechungsindex | 1,9727 | |
Vorkommen
Kupfer(I)-chlorid kommt natürlich als Mineral Nantokit vor.
Gewinnung und Darstellung
-chloride-sample.jpg)
Kupfer(I)-chlorid kann durch Reduktion von Kupfer(II)-sulfat mit Natriumdisulfit in halbkonzentrierter Salzsäure hergestellt werden. Weitere Möglichkeiten zur Herstellung sind die Reduktion von Kupfer(II)-chlorid mit Elektrolytkupfer in siedender Salzsäure oder durch Zink, Hypophosphorsäure, Hydrazin oder Natriumsulfit
sowie durch Ausfällen aus kochsalzhaltiger Kupfersulfat-Lösung mittels durchgeleiteten Schwefeldioxid.
Alternativ bildet sich Kupfer(I)-chlorid beim Erhitzen von Kupfer(II)-chlorid mit metallischem Kupfer in konzentrierter Salzsäure als komplexe Säure H[CuCl2]. Beim Verdünnen der Lösung zerfällt sie unter Abspaltung von Salzsäure und Bildung eines weißen, schwerlöslichen Niederschlags von CuCl.
Großtechnisch wird es durch Reaktion von Kupfer mit Chlor bei Temperaturen zwischen 450 und 900 °C gewonnen.
Eigenschaften
Reines Kupfer(I)-chlorid ist schneeweiß, jedoch durch Oxidation zu basischem Kupfer(II)-chlorid Cu(OH)Cl oft grünlich gefärbt.
Eine Lösung von Kupfer(I)-chlorid in Ammoniak ist in der Lage, Kohlenstoffmonoxid unter Bildung der Komplexverbindung [CuCl(CO)(H2O)2] zu absorbieren. Ebenso bilden außer Ammoniak Acetylen und Olefine entsprechende Komplexverbindungen. Es besitzt eine Kristallstruktur vom Zinkblende-Typ mit der Raumgruppe F43m (Raumgruppen-Nr. 216) (a = 541,6 pm). Bei 407 °C erfolgt der Übergang in eine Hochtemperaturmodifikation vom Wurtzit-Typ mit der Raumgruppe P63mc (Nr. 186) (a = 391, c = 642 pm). Die Bildungsenthalpie beträgt −138,1 kJ/mol.
Verwendung
Kupfer(I)-chlorid wird verwendet:
- als Katalysator für viele organische Reaktionen (MCS-Synthese)
- zur phosgenfreien Polycarbonat-Herstellung
- bei der Sandmeyer-Reaktion
- bei der Olefin-Oxidation
- bei der Ammonoxidation zu Acrylnitril
- zur Herstellung von Phthalocyanin-Blau-Pigmenten
- zur Absorption von Kohlenstoffmonoxid in einer Gasbürette


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 17.04. 2024


